Na etapie planowania leczenia lekarz określa całkowitą dawkę, którą napromieniana jest zmiana nowotworowa.
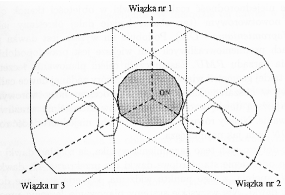
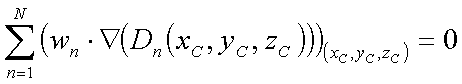
| - wkład gradientu od n-tej wiązki obliczony po rozkładzie dawki. |
Izotopy i wiązki stosowane w teleradioterapii
W teleradioterapii wykorzystuje się izotopy o długim czasie półrozpadu. Już w roku 1912 we Wrocławiu wprowadzono do użytku aparat zwany "bombą radową" wykorzystujący izotop 226Ra emitujący promieniowanie γ o energiach 0.24-2.20 MeV. Wadą tego izotopu była jego mała dostępność i wysoka cena
.
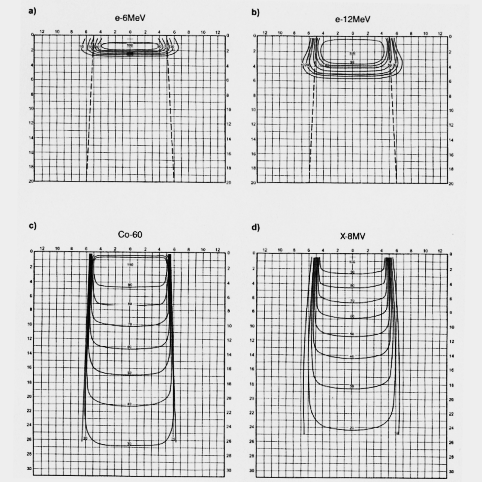
W latach pięćdziesiątych zaczęto stosować izotop 60Co (i stosuje się go z powodzeniem do dziś), emitujący promieniowanie γ o energiach 1.17 MeV i 1.33 MeV. Dawka głębokościowa osiąga maksimum na głębokości około 5 cm pod powierzchnią skóry, dzięki czemu niskie jest napromienienie naskórka przy naświetlaniu warstw położonych głębiej.
Innym izotopem wykorzystywanym w teleradioterapii jest 137Cs. Emituje on promieniowanie γ o energii 0.661 MeV. Jednakże ze względu na małą aktywność tego izotopu aparaty cezowe musiały pracować przy odległości źródło - skóra od 15 do 35 cm. Uniemożliwiało to osiągnięcie dużych wartości dawki głębokiej i aparaty te zaczęły wychodzić z użycia.
Obecnie w teleradioterapii używa się także wiązek elektronów (a nie promieni γ. Spowodowane jest to tym, iż elektrony przyspieszone do odpowiedniej energii (od 6 MeV do ok. 35 MeV) osiągają dawkę maksymalną na głębokości ok. 5 cm, a następnie rozkład dawki szybko zanika dzięki czemu nie są naświetlane tkanki znajdujące się za guzem nowotworowym. Ze względu na dobrze określony zasięg, wiązki elektronów są wykorzystywane do napromieniania obszarów położonych na powierzchni ciała, lub niezbyt głęboko.
Jeszcze korzystniejszy rozkład dawki głębokościowej mają protony (o energii 60 MeV - 250 MeV) i neutrony prędkie (5MeV - 40 MeV) oraz jony cięższe (C, N, O, Xe - energie rzędu GeV) wykorzystywane w terapii hadronowej.
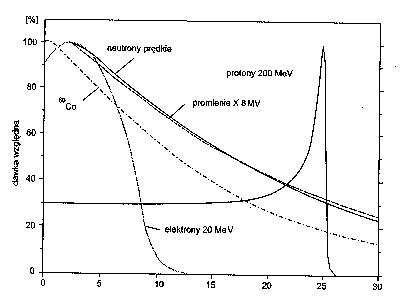
Polega na napromienianiu nowotworu neutronami prędkimi, protonami, lub ciężkimi jonami. Konieczność stosowania tych cząstek wynikła z tego iż około 33% wszystkich nowotworów jest radioodpornych na napromienianie konwencjonalne (wiązkami elektronów lub promieniowaniem γ). Radioodporność rozumie się tu jako konieczność (w celu wyleczenia) zastosowania dawki promieniowania powodującej w tkankach sąsiednich komplikacje przekraczające dopuszczalny margines. Neutrony charakteryzują się wyższym współczynnikiem liniowego przekazywania energii oraz współczynnikiem względnej skuteczności biologicznej, aniżeli odpowiadające im elektrony. Jednakże terapia neutronowa jest bardzo kosztowna, co stoi na przeszkodzie w jej upowszechnianiu. Protony mają skończony zasięg, zależny od energii inicjującej. Przy odpowiednim wyselekcjonowaniu energii protonów, charakterystyka głębokościowa wiązki może być płaska na całej głębokości interesującego z punkty widzenia terapii, przedziału i spadać prawie do zera pod koniec przedziału. Stosowany zakres energetyczny obejmuje protony o energiach od 60 MeV do około 250 MeV. Protony o mniejszych energiach stosowane są głównie do terapii nowotworów gałki ocznej, protony o energiach większych do terapii głębokościowej. Obecnie radioterapia protonowa jest an etapie wychodzenia z okresu badań i wdrażania jej do codziennego użytku w szpitalach. Przeszkodą jest tu znowu cena, tym razem jednak nie chodzi o cenę terapii jednej osoby, lecz o koszt związany z zakupem aparatury, który dziesięciokrotnie przewyższa koszt zakupu aparatu do terapii konwencjonalnej. Terapia przy pomocy jonów ciężkich nadal znajduje się w fazie badawczej. Jedyny ośrodek prowadzący leczenie tą metodą znajduje się w Japonii.
Terapia borowo_neutronowa (BNCT)
Polega na nasyceniu tkanki nowotworowej atomami 10 B podanymi w odpowiednim farmaceutyku, a następnie napromieniowaniu tej tkanki neutronami o energiach termicznych i epitermicznych. W wyniku wychwytu neutronów następuje emisja cząstki β oraz odrzut jądra 7Li oraz następuje emisja energii o wartości 2.8 MeV. W zależności od rozmiarów poszczególnych komórek zasięgi tych cząstek są rzędu 5 - 9 μm. Metoda ta stosowana jest przy leczeniu nowotworów mózgu (np. glejaków niewielkich rozmiarach podlegających eliminacji (rzędu kilkudziesięciu mm3 lub pojedynczych cm3.
Aparaty stosowane w teleradioterapii
Medyczne akceleratory liniowe
Zasada działania tych akceleratorów polega na przyspieszaniu elektronów w rurze akceleracyjnej będącej rezonatorem zasilanym przez lampę mikrofalową. Wstępnie przyspieszone elektrony wprowadzane są do rury akceleracyjnej przez zasilane impulsowo działo elektronowe. Wiązkę elektronów po ich ostatecznym przyspieszeniu formuje i ogniskuje system magnesów i soczewek magnetycznych, który kieruje ją na folię rozpraszającą, wyrównującą rozkład elektronów w wiązce.
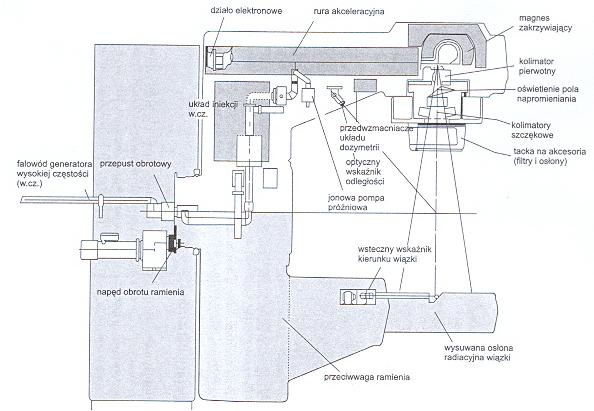
Rys. Schemat akceleratora medycznego. [6]

Bomby kobaltowe
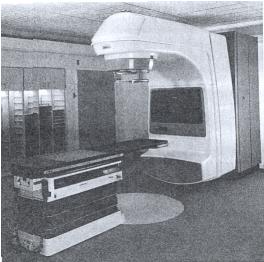
Izotop 60Co podczas rozpadu emituje dwa fotony γ o energii odpowiednio: !.17MeV i 1.33 MeV. Posiada także wysoką aktywność (do kilkuset TBq). Dzięki tym cechom jest bardzo atrakcyjnym izotopem jeśli chodzi o wykorzystanie go do teleradioterapii. Możliwe jest bowiem w aparacie kobaltowym wykorzystanie próbki izotopu o małej objętości (ok 10 cm3.
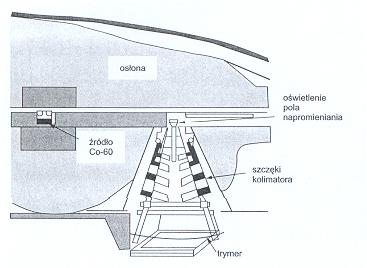
Rys. Schemat konstrukcji głowicy bomby kobaltowej [6]

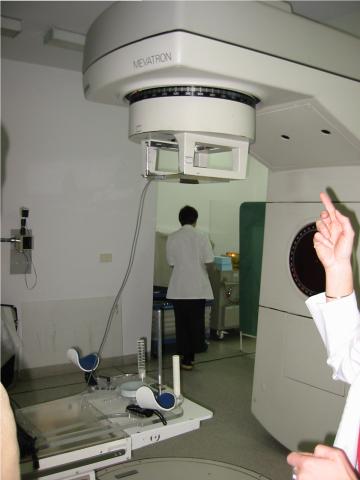
Akceleratorach i bomby kobaltowe skonstruowane są w taki sposób, aby możliwe było napromienianie pacjenta z kilku stron. Na zdjęciu powyżej ukazane jest ustawienie głowicy aparatu kobaltowego zapewniające napromienianie z prawej strony głowy pacjenta. Poniżej przedstawiono rysunek ukazujący wszystkie osie obrotu i kierunki w jakich głowica może się przesuwać.
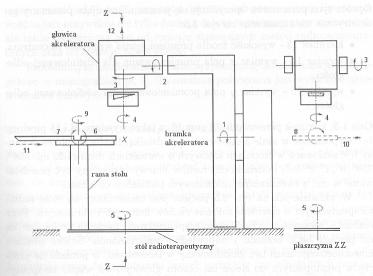
Rys. Osie obrotu głowicy akceleratora i kierunki ruchów liniowych: