![]()
Cykl Carnota jest dobrym przykładem do wprowadzenia jeszcze jednej ważnej funkcji stanu. Zauważmy, że ze wzorów (13.3) i (13.8) wynika związek
|
|
(13.12) |
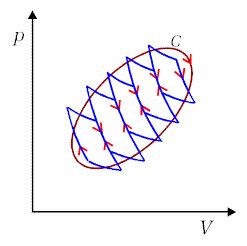
Związki te można łatwo uogólnić na dowolny cykl odwracalny traktując go jako złożenie wielu cykli Carnota, patrz Rys.13.3. Wówczas dla każdego elementarnego cyklu mamy
|
|
(13.13) |
Stosunek ilości ciepła pobranego z danego źródła do jego temperatury
bezwzględnej ![]() nazywamy
ciepłem zredukowanym. Widzimy więc, że suma
ciepeł zredukowanych w każdym elementarnym cyklu Carnota równa jest zeru.
nazywamy
ciepłem zredukowanym. Widzimy więc, że suma
ciepeł zredukowanych w każdym elementarnym cyklu Carnota równa jest zeru.
 |
Kiedy zapiszemy takie równania dla |
|
|
|
(13.14) | |
| Zwróćmy uwagę, że adiabaty znajdujące się
wewnątrz konturu przekrywają się parami, co odpowiada sprężaniu i
rozprężaniu gazu. W rezultacie następuje kompensacja pochodzących od
nich wkładów i sumaryczny cykl zawiera tylko elementy brzegowe izoterm i
adiabat. W ten sposób przybliżamy dowolny odwracalny cykl kołowy sumą
cykli Carnota. Kiedy liczba cykli elementarnych |
||
| Rys.13.3. Każdy proces odwracalny można aproksymować złożeniem cykli Carnota. |
|
(13.15) |
Widzimy, że całka po obwodzie zamkniętym z wyrażenia ![]() równa jest zeru. Oznacza to również, że w przypadku procesu przeprowadzającego
układ ze stanu A do stanu B całka z tego wyrażenia
nie będzie zależeć od drogi całkowania. (Przypomnij sobie analogiczną własność
pracy wykonywanej w polu sił zachowawczych, omawianą w lekcji czwartej.) Własność
ta oznacza, że funkcja określona tą całką jest funkcją stanu. Funkcję tą
poznaliśmy już w lekcji dwunastej w
interpretacji statystycznej jako wielkość związaną z prawdopodobieństwem
stanu układu. Nosi ona nazwę entropii i oznaczana
jest przez S. Mamy więc:
równa jest zeru. Oznacza to również, że w przypadku procesu przeprowadzającego
układ ze stanu A do stanu B całka z tego wyrażenia
nie będzie zależeć od drogi całkowania. (Przypomnij sobie analogiczną własność
pracy wykonywanej w polu sił zachowawczych, omawianą w lekcji czwartej.) Własność
ta oznacza, że funkcja określona tą całką jest funkcją stanu. Funkcję tą
poznaliśmy już w lekcji dwunastej w
interpretacji statystycznej jako wielkość związaną z prawdopodobieństwem
stanu układu. Nosi ona nazwę entropii i oznaczana
jest przez S. Mamy więc:
|
|
(13.16) |
Dla kołowego procesu odwracalnego mamy
|
|
(13.17) |
Dla przemiany przeprowadzającej w sposób odwracalny układ ze stanu A do stanu B
|
|
(13.18) |
Podana tu definicja nie pozwala na wyznaczenie bezwzględnej wartości entropii bowiem z zależności (13.18), widać, że
|
|
(13.19) |
Dla wyznaczenia entropii układu w danym stanie musielibyśmy znać wartość
bezwzględną entropii stanu początkowego. Możemy jednak wyznaczyć przyrost
entropii w danym procesie i to (jak zobaczymy) ma pryncypialne znaczenie dotyczące
określenia możliwości zachodzenia oraz kierunku przebiegu procesów w
przyrodzie. Ważną cechą entropii jest także jej addytywność, co
oznacza, że entropia układu jest sumą entropii podukładów. Warto też zwrócić
uwagę, że ponieważ w przemianie adiabatycznej mamy ![]() to
wartość entropii jest dla tej przemiany stała;
to
wartość entropii jest dla tej przemiany stała; ![]() .
Proces adiabatyczny nazywa się dlatego procesem
izoentropowym.
.
Proces adiabatyczny nazywa się dlatego procesem
izoentropowym.
Zauważmy, że w przypadku procesów nieodwracalnych wzrasta oddane otoczeniu ciepło o znaku ujemnym w stosunku do ciepła pobranego, któremu przypisaliśmy znak dodatni. Przyczyną jest niekwazistatyczny przebieg procesu, niedoskonała izolacja układu itp.
Sprawność silników nieodwracalnych jest mniejsza niż odwracalnego silnika Carnota. Z nierówności (13.10) wynika, że
|
|
(13.20) |
co możemy przepisać w postaci
|
|
(13.21) |
Porównując tę zależność ze wzorem (13.12) widzimy, że ciepło zredukowane w procesach nieodwracalnych jest mniejsze niż w procesach odwracalnych Wartość całki z lewej strony wzoru (13.17) też będzie mniejsza w procesach nieodwracalnych niż w odwracalnych, dla których wartość ta równa jest zeru. Łącznie dla obu typów procesów możemy zapisać nierówność postaci
|
|
(13.22) |
Nierówność ta zwana jest nierównością Clausiusa. Przypadek znaku równości dotyczy procesów odwracalnych.
Porównajmy ze sobą sumaryczne ciepło zredukowane i zmiany entropii dla przemian odwracalnych i nieodwracalnych. Rozpatrzmy cykl kołowy, w którym przemiana ze stanu A do B jest nieodwracalna, a przemiana z B do A jest odwracalna. W oparciu o nierówność Clausiusa możemy napisać
|
|
(13.23) |
gdzie wskaźnikami (n) i (o) oznaczyliśmy odpowiednio przemianę nieodwracalną i odwracalną. Dla przemiany odwracalnej mamy
|
|
(13.24) |
Biorąc to pod uwagę możemy wzór (13.23) przepisać w postaci
|
|
(13.25) |
lub inaczej
|
|
(13.26) |
Oznacza to, że sumaryczne ciepło zredukowane w procesie nieodwracalnym jest
mniejsze od zmiany entropii. Dla układu izolowanego nie wymieniającego ciepła z otoczeniem
mamy ![]() ,
czyli
,
czyli
|
|
(13.27) |
Wzór (13.26) możemy dla takiego przypadku napisać w postaci
|
|
(13.28) |
Rezultat ten znany jest jako prawo wzrostu entropii. Entropia układu izolowanego, w którym zachodzą procesy nieodwracalne może tylko rosnąć.
Jeżeli w układzie zachodzą wyłącznie procesy odwracalne, albo układ osiągnął stan równowagi termodynamicznej wtedy entropia pozostaje stała.
Jak wspominaliśmy już, stwierdzenie to stanowi zasadniczą wartość pojęcia entropii. Jest to funkcja stanu określająca kierunek przebiegu procesów, zarówno wyidealizowanych (odwracalnych) jak i rzeczywistych. Określając zmiany entropii możemy przewidzieć, czy dany proces jest możliwy, czy też nie lub czy może zajść samorzutnie w układzie pozostawionym sobie.