![]() ,
,
Związek pomiędzy makroskopową i mikroskopową definicją entropii
Jeżeli korzystając z rozwiązania zadania 13.4 (a więc wychodząc z definicji entropii danej wzorem (13.16)) określisz zmianę entropii przy izotermicznym (T1=T2) rozprężaniu 1-go mola gazu doskonałego od objętości V1 do V2, oraz określisz logarytm stosunku prawdopodobieństwa stanu końcowego (NA cząsteczek w objętości V2) do prawdopodobieństwa stanu początkowego (NA cząsteczek w objętości V1) to przekonasz się, że otrzymasz te same wyrażenia, tj.
|
|
W wyrażeniu po prawej stronie W2=1 jest
prawdopodobieństwem, że wszystkie cząsteczki są w objętości V2,
natomiast W1 jest prawdopodobieństwem, że wszystkie
cząsteczki po rozprężeniu znajdą się w objętości V1 .
Wartość tę nietrudno określić zauważając, że pojedyncza cząsteczka będąc
w objętości V2 znajdzie się w obszarze o objętości
V1 z prawdopodobieństwem będącym stosunkiem V1/V2.
Dla większej liczby cząsteczek prawdopodobieństwo to jest iloczynem
prawdopodobieństw, bowiem zakładamy że położenia cząsteczek są od siebie
niezależne. Dla wszystkich cząsteczek mamy więc 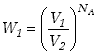 .
Stosunek tych prawdopodobieństw jest prawdopodobieństwem termodynamicznym
czyli wagą statystyczną stanu o objętości V2 w
stosunku do stanu o objętości V1. Pamiętając, że k=R/NA
widzimy, po prostych przekształceniach algebraicznych, równoważność
obu definicji entropii.
.
Stosunek tych prawdopodobieństw jest prawdopodobieństwem termodynamicznym
czyli wagą statystyczną stanu o objętości V2 w
stosunku do stanu o objętości V1. Pamiętając, że k=R/NA
widzimy, po prostych przekształceniach algebraicznych, równoważność
obu definicji entropii.