ETAPY RADIOTERAPII
PLANOWANIE LECZENIA
Na czym polega planowanie radioterapii
Na podstawie obrazu anatomicznego pacjenta z zaznaczonym obszarem tarczowym (CTV) oraz z zaznaczonymi obszarami krytycznymi (tkanki zdrowe o szczególnej promienioczułości lub stanowiące potencjalne źródło komplikacji) dokonuje się wyboru techniki radioterapii (teleradioterapia, brachyterapia, terapia radioizotopowa). Następnie oblicza się rozkład dawek w objętościach tarczowych i objętościach krytycznych, dla dobieranych odpowiednio rozmaitych ustawień aparatury (np. kątów padania wiązek zewnętrznych, rozkładu źródeł brachyterapeutycznych w aplikatorze) oraz elementów pomocniczych wykonanych indywidualnie dla pacjenta (bloki, osłony, elementy unieruchamiające). Ostatecznie wybiera się optymalny plan leczenia i wykonuje szczegółowe obliczenia rozkładu dawek odpowiadających przewidywanym warunkom napromieniania.
Prawdopodobieństwo miejscowego wyleczenia
Zależność prawdopodobieństwa miejscowego wyleczenia z nowotworu od dawki przedstawia poniższy wzór:
gdzie:
- N0 - początkowa liczba komórek nowotworowych
- d - dawka frakcyjna - dawka podana pacjentowi podczas jednego seansu terapeutycznego
- D - dawka całkowita
- &alpha, β - parametry określające promienioczułość komórek nowotworowych
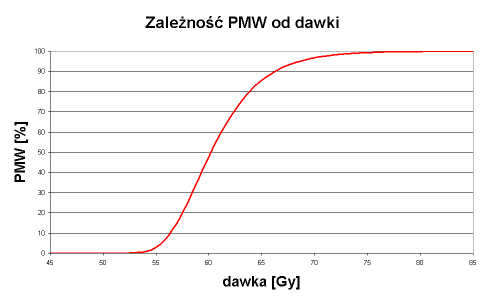
Rys. Zależność PMW od dawki [3]
W obliczeniach przyjęto, że początkowa liczba komórek nowotworowych wynosi 108, dawka frakcyjna 2 Gy, parametr α=0,230 Gy-1, β=0,023 Gy-2.
Uważa się, że pacjent jest wyleczony, gdy zabite zostaną wszystkie komórki nowotworowe. Analizując wykres widać, że gdy dawka jest mniejsza niż około 57 Gy nie jest możliwe wyleczenie nowotworu. Gdy dawka przekroczy 80 Gy wszyscy pacjenci zostają wyleczeni.
Niestety powyższy wykres opisuje teoretyczny model działania promieniowania. Ze względu na brak ścisłej informacji o początkowej liczbie komórek nowotworowych, ich wrażliwości na promieniowanie, szybkości namnażania określając dawkę aplikowaną pacjentowi lekarz kieruje się dość ogólnymi wytycznymi. Zazwyczaj dawka ta nie jest dobrana optymalnie, jest zbyt duża lub zbyt mała. W tabeli poniżej przedstawiono oszacowanie niepewności określenia dawki w poszczególnych etapach planowania:
Źródła niepewności dawki |
Niepewność |
| wyznaczenie dawki w klinicznej objętości tarczowej |
3.1 % |
| wyznaczenie dawki w pozostałych punktach |
0.6 % |
| niestabilność działania przyspieszacza |
1.0 % |
| procedury zbierania danych obrazowych do planowania leczenia |
1.2 % |
| brak odtwarzalności ułożenia pacjenta i ruchy narządów wewnętrznych |
2.5 % |
| procedury obliczeniowe |
3.0 % |
| sposób określenia dawki aplikowanej pacjentowi |
3.0 % |
| całkowita niepewność określenia dawki |
6.0 % |
Tab. Oszacowanie niepewności określenia dawki zaaplikowanej pacjentowi [3]
Do opisu faktycznej zależności pomiędzy dawką a prawdopodobieństwem wyleczenia służy tzw. znormalizowany gradient dawki określony dla dawki D0 wzorem:
Należy pamiętać także o tym, że guzów swej budowie może nie być jednorodny, co będzie powodowało, że niektóre części nowotworu dostaną większą dawkę niż inne i w efekcie nowotwór nie zostanie całkowicie wyleczony. Poniższy wzór uwzględniający niejednorodność guza pozwala wyznaczyć dawkę tak, aby każda część nowotworu napromieniona została równomiernie.
gdzie:
- {Dijk} - rozkład dawki w objętości guza
- σ - odchylenie standardowe dawki
- Dśr - średnia dawka absorbowana w objętości guza
Prawdopodobieństwo wystąpienia uszkodzenia zdrowej tkanki
Przy leczeniu promieniowaniem jonizującym należy zadbać o to, aby nie wystąpiły uszkodzenia popromienne tkanek zdrowych.
Uszkodzenia popromienne dzielimy na wczesne i późne. Wczesne występują już w trakcie leczenia lub niedługo po jego zakończeniu i zazwyczaj są to ostre reakcje popromienne skóry i nabłonków wyściełających jamy ciała. Uszkodzenia późne mają wpływ na funkcjonowanie głównych organów wewnętrznych takich jak serce, wątroba, nerki...
Zależność wystąpienia uszkodzenia tkanki od rozkładu dawki została opisana przez Lymana [4] wzorami:
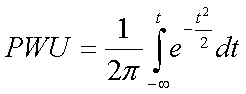
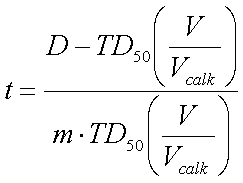
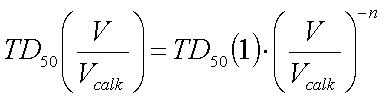
- TD50(1) - dawka, której podanie w całej objętości narządu powoduje jego uszkodzenie u 50% leczonych pacjentów
- TD50(V/Vcałk) - dawka, której podanie w objętości V narządu powoduje jego uszkodzenie u 50% leczonych pacjentów
- m - parametr określający nachylenie krzywej opisującej zależność PWU od dawki
- n - parametr określający zależność PWU od objętości (im większe n, tym narząd należy bardziej traktować jako zbudowany z jednostek funkcjonalnych połączonych równolegle)
W tabeli poniżej zamieszczono wartości m, n i TD50(1) dla najważniejszych narządów wewnętrznych.
Narząd |
n |
m |
TD50(1) |
| Serce |
0.35 |
0.10 |
48 Gy |
| Płuca |
0.87 |
0.18 |
24.5 Gy |
| Mózg |
0.25 |
0.15 |
60 Gy |
| Wątroba |
0.32 |
0.15 |
40 Gy |
| Nerki |
0.70 |
0.10 |
28 Gy |
| Jelito cienkie |
0.15 |
0.16 |
55 Gy |
| Rdzeń kręgowy |
0.1 |
0.20 |
50 Gy |
Tab. Maksymalne dawki napromienienia ważniejszych narządów wewnętrznych. [3]
W powyższych wzorach należy uwzględnić niejednorodność narządów wewnętrznych. Aby to zrobić należy zamiast objętości V użyć tzw. objętość efektywną Veff. Sposób jej obliczenia podali Burmann i Kutcher [5]:
gdzie:
- delta Vi - objętość otrzymująca dawkę Di
- Dmax - maksymalna dawka w narządzie
Podsumowując: w procesie planowania leczenia dąży się do maksymalizacji wyrażenia:
gdzie:
- PMW({Dijk}) - prawdopodobieństwo miejscowego wyleczenia z nowotworu
- PMUl - prawdopodobieństwo wystąpienia uszkodzenia narządu l
- L - liczba narządów wewnętrznych, które wpływają na ocenę planu leczenia
- sl - waga z jaką do wzoru wchodzi czynnik iloczynu opisujący PWU danego narządu (np. uszkodzenie rdzenia kręgowego jest znacznie bardziej niebezpieczne od uszkodzenia płuca)
Techniki komputerowego planowania radioterapii
Obecnie przy planowaniu radioterapii wykorzystuje się sprzęt komputerowy o wysokiej mocy obliczeniowej połączony poprzez sieć komputerową szpitala z symulatorem, rentgenowskim tomografem komputerowym, oraz, czasem, tomografem rezonansu magnetycznego, a także z analizatorem pola, czyli układem do zbierania danych o wiązkach (połączenie to jest szczególnie ważne podczas wprowadzania danych o wiązkach). System taki posiada stację graficzną , podświetlany digitizer (urządzenie do cyfrowego odczytu współrzędnych (x,y) wybranego punktu np. na zdjęciu rentgenowskim) dużego formatu (A3 lub większy) oraz ploter (sterowane cyfrowo urządzenie to sporządzania wykresów) lub kolorowe drukarki graficzne.
Do takiego systemu komputerowego wprowadza się dane o wiązkach stosowanych podczas leczenia, a także danych o pacjencie - zazwyczaj jest to obraz anatomiczny badanej osoby wprowadzany bezpośrednio z przekrojów tomograficznych.
Dawki oblicza się na podstawie pewnych algorytmów. Te najdokładniejsze uwzględniają położenia i trójwymiarowy kształt niejednorodności. Bardziej dokładne oparte są na metodach Monte Carlo, charakteryzuje je jednak długi czas obliczeń. Jednakże obserwując tempo rozwoju sprzętu komputerowego można sądzić, iż już niedługo będą one stosowane rutynowo przy planowaniu radioterapii.
Po zakończeniu obliczeń przeprowadza się optymalizację leczenia polegającą na ostatecznym wyborze takiego układu parametrów wiązek, które do objętości tarczowej dostarczą zalecony rozkład dawek, zaś do innych tkanek pacjenta dawki jak najniższe.
Są dwie metody optymalizacji:
- optymalizacja wizualna - polega na interakcyjnej zmianie parametrów wiązek, doborze odpowiednich osłon i porównywaniu otrzymywanych rozkładów dawek. Na jej podstawie osoba planująca wybiera najlepszy plan napromieniania.
Rys.Przykład zastosowania filtra klinowego do optymalizacji dwuwymiarowego planu leczenia. Nowotwór mózgu napromieniany jest z oszczędzeniem gałki ocznej poprzez zastosowanie dwóch wiązek fotonowych 8 MeV o tej samej wadze (tzn. jednakowym wkładzie do dawki w punkcie centralnym) a) Zastosowanie wyłącznie pól otwartych daje niemożliwy do przyjęcia nierównomierny rozkład dawki. b) Modyfikacja obu pól filtrami klinowymi 45o (kolor zielony) daje bardziej jednorodny rozkład dawki w obszarze tarczowym [6]
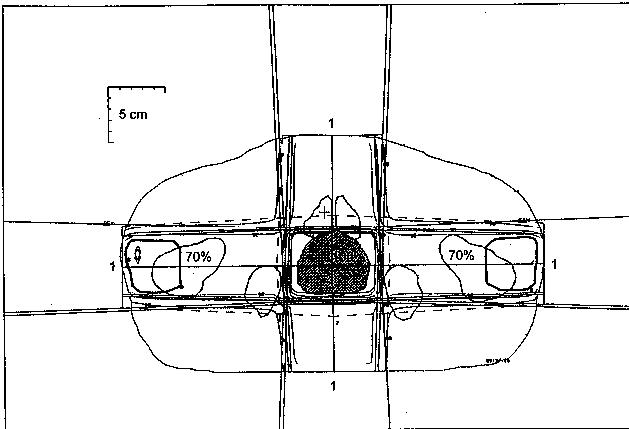
a)
b)
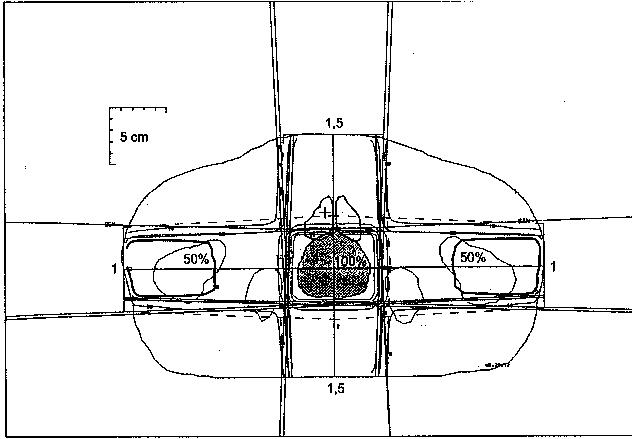
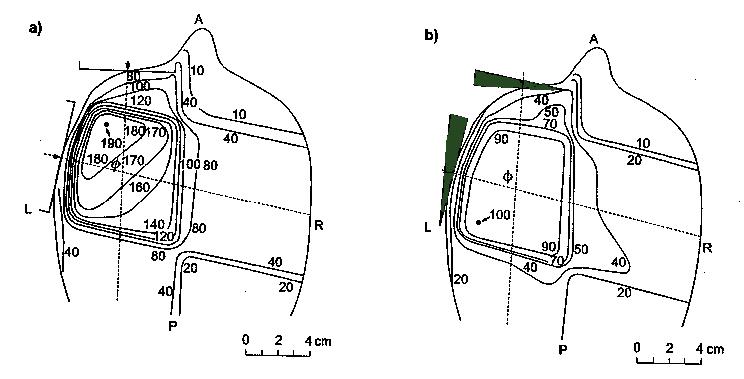
Rys. Optymalizacja dwuwymiarowego planu naświetlania obszaru wewnątrz miednicy techniką czteropolową.a) Wiązki fotonów o energii 6 MeV o jednakowej wadze. b) Zwiększenie wag wiązki przedniej i tylnej, względem wiązek bocznych pozwala zmniejszyć dawki w skrajnych bocznych obszarach miednicy. [6]
- optymalizacja matematyczna - polega na zdefiniowaniu tzw. funkcji celu wykorzystującej elementy modeli biofizycznych i parametryzującej rozkład dawek w objętości tarczowej, z nałożonymi ograniczeniami wielkości dawek w narządach krytycznych. Wykorzystując komputerowe techniki wieloparametrowej minimalizacji, można numerycznie ustalić optymalne parametry wiązek. Stosowanie tej metody w systemach planowania jest jeszcze dość ograniczone.
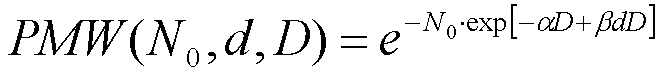
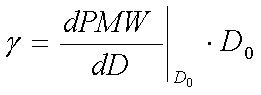
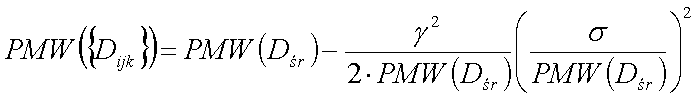
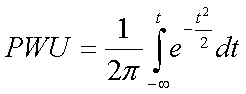
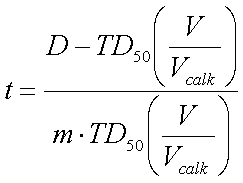
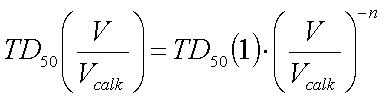
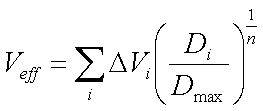
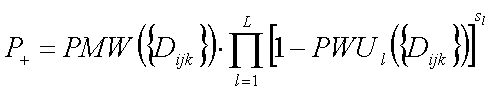
 a)
a) b)
b)