Z przedstawionych faktów widać, że w świecie atomów istnieją bardzo wyraźne reguły, ale nie odpowiadają one regułom, którymi kieruje się fizyka klasyczna. W 1913 roku duński fizyk Niels Bohr zaproponował model atomu, który wprawdzie naruszał zasady fizyki klasycznej ale, ... opisywał wyniki doświadczeń. Punktem wyjścia było klasyczne założenie, że elektron porusza się w atomie po kołowej orbicie wskutek przyciągania elektrostatycznego przez dodatnio naładowane jądro atomowe. Przyjął też nieznane w fizyce klasycznej założenia zwane dziś postulatami Bohra:
Oczywiście, postulaty Bohra pozostają w ścisłej relacji z postulatami Plancka i Einsteina, ale odnoszą się bezpośrednio do budowy atomu. Kwantowanie emisji (Planck) czy absorpcji (Einstein) promieniowania jest tu naturalna konsekwencją postulatów Bohra dotyczących struktury atomu.
Zastosujmy postulaty Bohra do atomu o składającego się z jądra o masie M
i ładunku +Ze oraz jednego elektronu o masie m i ładunku
-e. Liczbę
Z nazywamy liczbą atomową. Zwróćmy uwagę, że model taki
dotyczy atomu wodoru lub atomów "wodoropodobnych": tj. jonów z
jednym tylko elektronem. Używając terminu "atom" będziemy więc tu
rozumieć atom wodoropodobny. Warunek krążenia elektronu z prędkością ![]() na orbicie o numerze n, która ma promień rn
sprowadza się do równości siły przyciągania elektrostatycznego i siły
odśrodkowej,
na orbicie o numerze n, która ma promień rn
sprowadza się do równości siły przyciągania elektrostatycznego i siły
odśrodkowej,
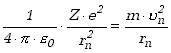 . . |
(13.2.1) |
Z pierwszego postulatu Bohra wynika, że
| (13.2.2) |
Podstawiając wyrażenie na prędkość ![]() wzięte ze wzoru (13.2.2) do wzoru (13.2.1) otrzymujemy wzory określające
promień n-tej orbity stacjonarnej elektronu, oraz prędkość
elektronu na tej orbicie
wzięte ze wzoru (13.2.2) do wzoru (13.2.1) otrzymujemy wzory określające
promień n-tej orbity stacjonarnej elektronu, oraz prędkość
elektronu na tej orbicie
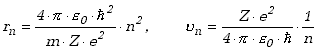 |
(13.2.3) |
Na energię atomu składa się energia kinetyczna elektronu na orbicie i energia potencjalna jego wiązania. (Zakładamy, że jądro atomowe jest nieruchome.)
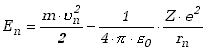 |
(13.2.4) |
Wykorzystując związek (13.2.1) możemy zapisać inaczej wyrażenie (13.2.4)
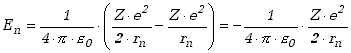 |
(13.2.5) |
Promień n-tej orbity rn mamy już wyliczony, wzór (13.2.3). Wykorzystując to możemy zapisać wyrażenie na energię elektronu w postaci
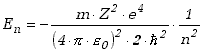 |
(13.2.6) |
Kiedy elektron przechodzi ze stanu n do stanu m, wypromieniowując
zgodnie z drugim postulatem Bohra energię ![]() to różnica energii atomu wynosi
to różnica energii atomu wynosi
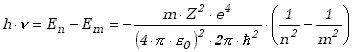 |
(13.2.7) |
Odpowiadająca tej różnicy energii częstotliwość fali wynosi
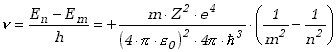 |
(13.2.8) |
(Zwracamy uwagę na zmianę kolejności wyrażeń w nawiasie po prawej stronie i związaną z tym zmianą znaku.) Liczba falowa (wzór 13.1.2) odpowiadająca temu przejściu wyrazi się wzorem
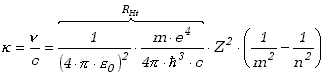 |
(13.2.9) |
Otrzymaliśmy wzór analogiczny do wzoru na serie widmowe atomu wodoru (13.1.5), jeśli przyjmiemy, że Z=1 (co odpowiada ładunkowi jądra atomu wodoru). Teraz jednak nie jest to już zwykłe zauważenie prawidłowości w danych pomiarowych, ale rezultat określonego założenia teoretycznego. Co więcej, na podstawie tego wzoru mamy wyznaczoną wartość stałej Rydberga, którą tu oznaczyliśmy przez RHt. Wartość tej stałej bardzo dobrze zgadza się z wartością wyznaczoną doświadczalnie. Jest to niewątpliwy sukces modelu atomu Bohra.