ENTROPIA.
II. PRAWO (ZASADA) TERMODYNAMIKI
* Definicje statystyczna i termodynamiczna entropii
* Definicja statystyczna entropii
* Definicja termodynamiczna entropii
* Perpetuum mobile III. rodzaju


Jeżeli w układzie mamy N cząstek należących do dwóch
rodzajów, to liczba sposobów rozkładu tych N cząstek na części N1 i
N2 wynosi Ω(N1, N2)
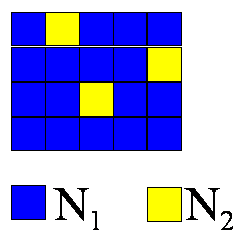
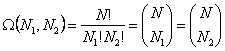
gdzie symbol Newtona oznacza ![]() .
.
Kiedy układ zostanie podzielony na dwa nie oddziałujące
ze sobą podukłady, wtedy liczba sposobów Ω, na jakie można otrzymać
określony stan makroskopowy jest równa iloczynowi liczby sposobów, na jakie
można otrzymać oba podukłady Ω1 i Ω2:
![]()
Z tego iloczynu możemy utworzyć pożądaną wartość addytywną
![]()
Na tej podstawie definiujemy entropię S:
![]()
Prawdopodobieństwo P znalezienia określonego stanu jest
odwrotnie proporcjonalne do liczby sposobów Ω, na jakie można otrzymać
cały stan makroskopowy, tzn Ω = 1/P . Zatem entropię możemy zapisać w
bardziej użytecznej postaci:
![]()
Definicję statystyczną entropii otrzymujemy ostatecznie jako
![]()
Entropia jest miarą
nieuporządkowania w układzie. Im
większy nieporządek (duża Ω ),
tym większa entropia S.

W sformułowaniu termodynamicznym, entropia gazu idealnego jest określona przez zależność:
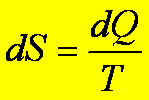
Teraz pierwsza zasada termodynamiki może być zapisana w
postaci:
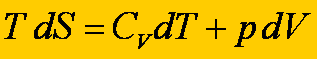

1. W procesach nieodwracalnych entropia układu rośnie.
2.
W procesach odwracalnych entropia układu jest stała.
3.
Entropia układu w stanie równowagi ma wartość maksymalną.
Dla procesów
odwracalnych TdS = đQ, zaś w procesach nieodwracalnych TdS > đQ .
Obie te zależności można połączyć w jedno równanie:
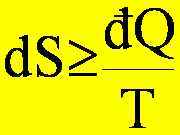
II prawo termodynamiki może być formułowane na kilka
sposobów:
1. (Entropowe) Entropia
układu izolowanego nie maleje

2. (Clausiusa) Nie jest
możliwy taki proces, którego jedynym rezultatem byłoby przeniesienie ciepła z
ciała zimnego do gorącego.
3. (Kelvina) Nie jest
możliwy taki proces, którego jedynym rezultatem byłoby wykonanie pracy
równoważnej ciepłu otrzymanemu ze źródła.
Wszystkie trzy sformułowania są
sobie równoważne. Aby to pokazać przyjmiemy jako podstawę sformułowanie
entropowe: Entropia układu izolowanego nie maleje ![]() .
.
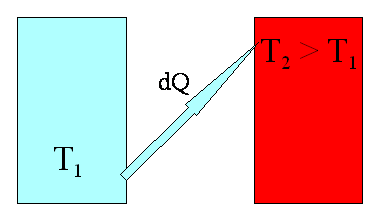
Dowód równoważności sformułowań 1) i 2). W kontekście sformułowania Clausiusa 2) spontaniczne (bo w
układzie izolowanym) przeniesienie ciepła dQ z ciała zimnego do gorącego
skutkuje zmianami entropii dS1 ciała zimnego i dS2 ciała
gorącego. Oba te ciała stanowią układ izolowany.
Obie zmiany entropii wynoszą
odpowiednio ![]() oraz
oraz ![]() . Sumaryczna zmiana entropii wynosi
. Sumaryczna zmiana entropii wynosi
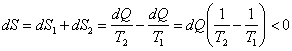 . Czyli dS < 0, ale
to jest niemożliwe, bo (na podstawie sformułowania entropowego) w układzie
izolowanym zmiana entropii musi być
. Czyli dS < 0, ale
to jest niemożliwe, bo (na podstawie sformułowania entropowego) w układzie
izolowanym zmiana entropii musi być ![]() .
.
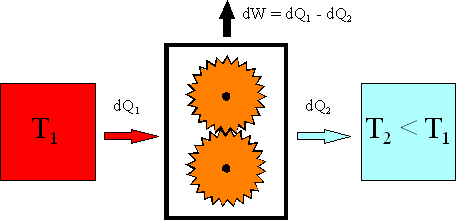
Dowód równoważności sformułowań 1) i 3). W kontekście sformułowania Kelvina 3) układ izolowany
składa się teraz ze zbiornika ciepła o temperaturze T1, maszyny
wykorzystującej pobrane ze zbiornika ciepło dQ1 na wykonanie pracy
dW oraz z chłodnicy o temperaturze T2, do której przenoszone jest
niewykorzystana część ciepła dQ2. Całe pobrane ciepło zostałoby
wykorzystane na wykonanie pracy, gdyby do chłodnicy nie było przekazywane żadne
ciepło, czyli gdyby dQ2 = 0.
Wymiana ciepła dokonuje się tylko
w zbiorniku i w chłodnicy. Zmiany entropii wynoszą w nich odpowiednio ![]() oraz
oraz ![]() . Sumaryczna zmiana entropii wynosi
. Sumaryczna zmiana entropii wynosi
![]() .
.
Wykonana praca wynosi ![]() . Gdyby całe pobrane ciepło zostało zamienione na pracę,
czyli gdyby
. Gdyby całe pobrane ciepło zostało zamienione na pracę,
czyli gdyby ![]() , wtedy
, wtedy ![]() . Wtedy jednak sumaryczna zmiana entropii wyniosłaby
. Wtedy jednak sumaryczna zmiana entropii wyniosłaby ![]() , czyli byłaby ujemna. To jest także niemożliwe, bo (na
podstawie sformułowania entropowego) w układzie izolowanym zmiana entropii musi
być
, czyli byłaby ujemna. To jest także niemożliwe, bo (na
podstawie sformułowania entropowego) w układzie izolowanym zmiana entropii musi
być ![]() .
.
Sensem II. zasady termodynamiki jest stwierdzenie, że nie można wykonać żadnej pracy mając do dyspozycji tylko źródło energii, a nie mając możliwości stworzenia przepływu tej energii. Samo tylko źródło energii, np. źródło ciepła bez chłodnicy, gdzie można to ciepło odprowadzać, przypomina potężnego siłacza tak dokładnie skrępowanego, że nie może on wykonać żadnego ruchu.
Wielu maniaków od dawna próbowało budować maszyny, które wykonywały by pracę bez zasilania energią. Taka maszyna, która łamałaby pierwszą zasadę termodynamiki nosi nazwę perpetuum mobile I. rodzaju.
Równie
naiwne byłyby próby zbudowania perpetuum mobile II-go rodzaju, czyli maszyny,
która otrzymywałaby energię z pojedynczego ciała zewnętrznego w postaci ciepła
i przekazywała to ciepło całkowicie innemu ciału w postaci pracy. Na zbudowanie
takiej maszyny nie pozwala II. zasada termodynamiki, która orzeka że nie
jest zatem możliwe zbudowanie takiej maszyny, której ciało robocze wykonywałoby
cykl otrzymując energię z pojedynczego ciała zewnętrznego w postaci ciepła i
przekazywało je całkowicie innemu ciału w postaci pracy.
II. zasada termodynamiki odpowiada jednocześnie na
pytanie ile najwyżej można otrzymać pracy W
z określonej ilości ciepła Q.
Ile
dostarczonego ciepła można zamienić na pracę? Najwyżej tyle, ile może tego
dokonać maszyna oparta o procesy odwracalne.
Z II-giej zasady termodynamiki
wynika, że maszyna cieplna musi mieć dwa ciała robocze: źródło ciepła i
chłodnicę. Maszyna działająca w oparciu o procesy odwracalne musi wrócić do
stanu początkowego, czyli musi pracować cyklicznie. Maszyna pracująca
cyklicznie może być zaprojektowana na różne sposoby. Najbardziej interesującym
cyklem i wygodnym dla analizy jest cykl złożony z dwóch izoterm i dwóch
adiabat, zwany cyklem Carnota, który można przedstawić jak na schematach
poniżej:
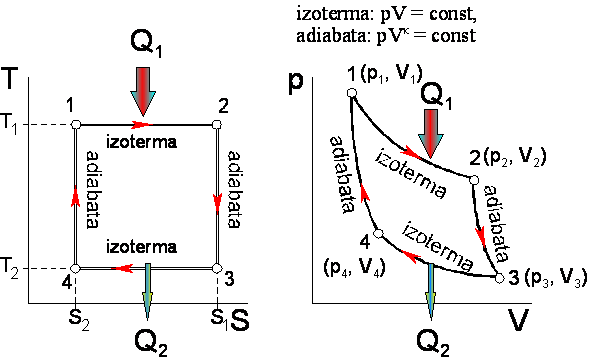
Oba schematy są
równoważne sobie: Lewy przedstawia cykl Carnota we współrzędnych (S, T) a prawy
we współrzędnych (V, p). Ponieważ w procesach adiabatycznych đQ = 0, to i dS =
0. Zatem procesy adiabatyczne są jednocześnie procesami izoentropowymi. Oznacza
to, że cykl Carnota może być zaprezentowany jako złożony z dwóch izoterm i
dwóch izoentrop (adiabat) w układzie S-T
Ciepło Q1
jest dostarczane do maszyny na górnym odcinku izotermy, a ciepło Q2
jest odprowadzane do chłodnicy na drugim odcinku izotermy. Na odcinkach adiabat
(izoentrop) ciepło, oczywiście, nie jest wymieniane.
Zmiana entropii na drodze 1-2 wynosi
![]()
na drodze 2-3
![]()
na drodze 3-4
![]()
oraz na drodze 4-1
![]()
Ponieważ znajdujemy się znowu w punkcie wyjścia, to
sumaryczna zmiana entropii jest równa zeru.
![]()
Otrzymaliśmy bardzo ważną zależność, jedną z najważniejszych w termodynamice
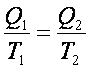
Współczynnik sprawności cieplnej maszyny definiujemy w
oczywisty sposób jako równy stosunkowi uzyskanej pracy W = Q1
–Q2 do wprowadzonego ciepła Q1
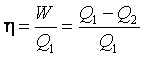
czyli
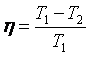
Gdy T1 = T2 (temperatury źródła
ciepła i chłodnicy są równe), wtedy η = 0.
Współczynnik η = 1 (czyli na pracę zamieniane jest całe dostarczone
ciepło) tylko wtedy, gdy T2 = 0, ale jest to niemożliwe, bo zgodnie
z III. zasadą termodynamiki nie możliwe uzyskanie temperatury równej dokładnie
zeru absolutnemu.

Oprócz perpetuum mobile pierwszego i drugiego rodzaju można
mówić także o perpetuum mobile (wieczny ruch) trzeciego rodzaju. Tak można nazwać ten rodzaj ruchu, który
trwa nieograniczenie długo, ale nie wykonuje żadnej użytecznej pracy.
Przykładem jest chaotyczny ruch termiczny molekuł w ciałach. W tym perpetuum
mobile musimy założyć, że zostały wyeliminowane wszystkie siły tarcia. Maszyna
złożona z umieszczonych w próżni cząstek nie wywierających na siebie sił
tarcia, kiedy zostanie raz puszczona w ruch i nie będzie wykonywała żadnej
pracy na obiektach zewnętrznych wtedy już pozostanie w ruchu nieograniczenie
długo. Codzienne obserwacje wskazują jednak, że w skali makroskopowej warunki
narzucone na taką maszynę nie mogą zostać spełnione.
W skali mikroskopowej prąd elektronów poruszających się w pierścieniu nadprzewodzącym będzie płynął nieograniczenie długo. Taki pierścień byłby przykładem perpetuum mobile trzeciego rodzaju gdyby można było zaniedbać dostarczanie energii koniecznej do utrzymania go w temperaturze, w której występuje nadprzewodnictwo. Idealne, z dobrym przybliżeniem, warunki działania takiego perpetuum mobile powstałyby wtedy gdyby pierścień nadprzewodzący z prądem został umieszczony w próżni kosmicznej.
