PODSTAWY
TERMODYNAMIKI
Podstawowe
pojęcia. Parametry i funkcje stanu. Proces termodynamiczny.
* Parametry stanu, funkcje stanu, równanie stanu
Termodynamikę można uważać za wszechstronną teorię zbiorów atomów i molekuł tworzących gazy, ciecze i ciała stałe. Jej domeną jest makroskopowy opis układów w całym dostępnym praktycznie zakresie temperatur (od 10-4 K do 106 K). Cała termodynamika jest zbudowana jedynie na czterech prawach, zwanych także zasadami:
Zerowe prawo (zasada) – ciała pozostające w kontakcie ze sobą mają jednakową temperaturę co oznacza, że możliwe jest zbudowanie termometru;
Pierwsze prawo (zasada) – suma energii i pracy jest zachowana w układzie zamkniętym;
Drugie prawo (zasada) – w układzie zamkniętym nie można całej dostępnej energii cieplnej zamienić na pracę;
Trzecie prawo (zasada) - nigdy nie będziemy mogli osiągnąć absolutnego zera temperatury stosując skończony ciąg procesów odwracalnych.
Termodynamika jest jednym z najpotężniejszych narzędzi, jakie możemy zastosować do opisu i analizy zjawisk w przyrodzie i technice.

Przedmiotem badań termodynamiki jest szeroko pojmowany układ termodynamiczny. Układem termodynamicznym nazywamy dowolne ciało lub zbiór ciał, które badamy metodami termodynamicznymi. Oznacza to dużą swobodę w rozumieniu pojęcia układu. Takim układem może być balon z gazem, mieszanina wody i piasku, bryła lodu, butelka z szampanem (szkło, ciecz, gaz) i wszystko inne, co przychodzi nam do głowy.
Do najprostszych układów termodynamicznych można zaliczyć: Zbiornik z gazem, zbiornik z cieczą lub bardziej złożony jest układ cieczy i ciała stałego.


Układem może też być, oczywiście, sam kryształ jak również i jakieś ciało szkliste.
Najważniejszą cechą termodynamiki jest, że nie przyjmuje ona do wiadomości istnienia atomów i molekuł. To założenie nie jest termodynamice potrzebne! Przedmiotem termodynamiki jest zatem opis makroskopowy układu, czyli taki, w którym właśnie nie przyjmujemy do wiadomości istnienia atomów i molekuł. Mówiąc wprost – termodynamika została zbudowana bez stosowania pojęć atomu i molekuły.
Kiedy – zgodnie z prawdą - przyjmiemy, że każde ciało składa się z atomów i molekuł czyli kiedy interesuje nas opis mikroskopowy układu wtedy musimy stosować metody statystyczne. Dział fizyki, którego przedmiotem są metody statystyczne nosi nazwę mechaniki statystycznej.
Temperatura jest jednym z najważniejszych pojęć termodynamiki. Jest ona miarą zawartości ciepła w jednostce objętości lub masy ciała.
Równowaga termiczna między dwoma lub kilkoma ciałami pozostającymi ze sobą w kontakcie termicznym występuje wtedy, gdy ustaje wszelki przepływ ciepła miedzy tymi ciałami. W takich warunkach wszystkie te ciała mają jednakową temperaturę.
Zasadą przechodniości w termodynamice jest zerowa zasada termodynamiki: Jeżeli dwa układy znajdują się w równowadze termicznej z trzecim układem, wtedy oba znajdują się w równowadze termicznej względem siebie.
Z zerowej zasady termodynamiki w oczywisty sposób wynika możliwość zbudowania termometru, czyli układu, który może osiągnąć tę samą temperaturę co i ciało będące w kontakcie z tym termometrem.
Kiedy na chwilę odejdziemy od opisu termodynamicznego i przyjmiemy do wiadomości istnienie atomów i molekuł wtedy temperatura może mieć być rozumiana jako miara energii kinetycznej drgań termicznych tych atomów i molekuł. Animacje symbolizują chaotyczny ruch cząstek gazu, drgania molekuł w krysztale molekularnym i atomów w krysztale atomowym lub jonowym.
Stanem układu nazywamy pełny zbiór zmiennych opisujących układ w określonym momencie („tu i teraz”).

Zmienne opisujące stan układu nazywamy parametrami stanu. Dla gazu idealnego w charakterze parametrów stanu wybieramy zwykle łatwe do zmierzenia ciśnienie, objętość i temperaturę (p, V, T)
W termodynamice bardzo ważną rolę spełniają funkcje stanu, czyli dowolne funkcje, których zmiennymi są parametry stanu.
Funkcja stanu wiążąca wszystkie parametry stanu, za pomocą których układ jest opisany, nosi nazwę równania stanu.

Przejście układu ze stanu opisanego parametrami (p1, V1, T1) do stanu (p2, V2, T2) nazywamy procesem termodynamicznym. Procesy termodynamiczne dzielimy najogólniej na odwracalne i nieodwracalne.
Wyidealizowanymi sytuacjami, reprezentującymi w przybliżeniu procesy odwracalne, mogą być sprężanie i rozprężanie adiabatyczne (bez wymiany ciepła) gazu oraz kołysanie deski na ostrzu klina:
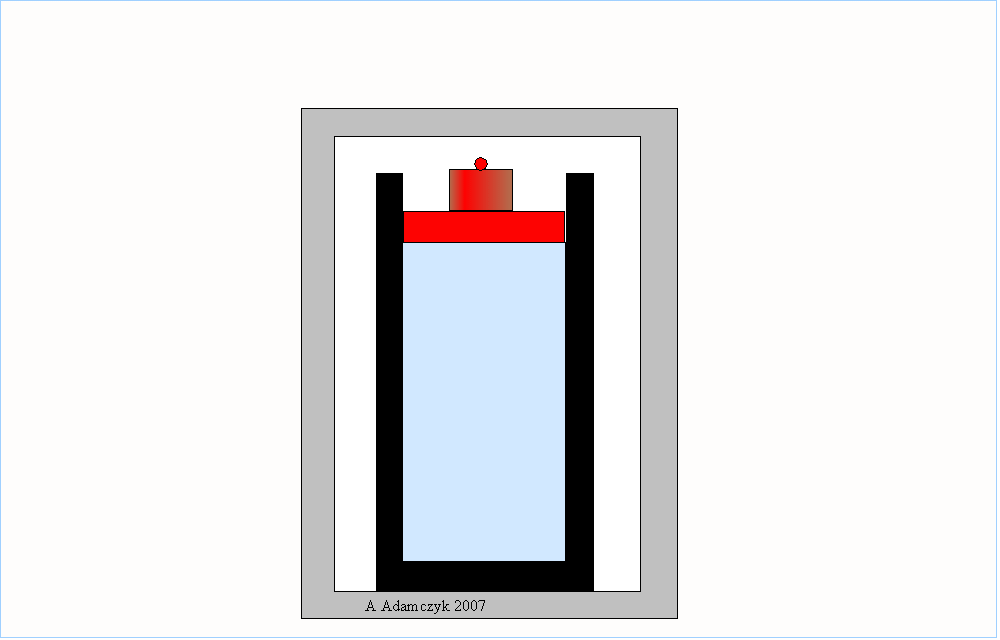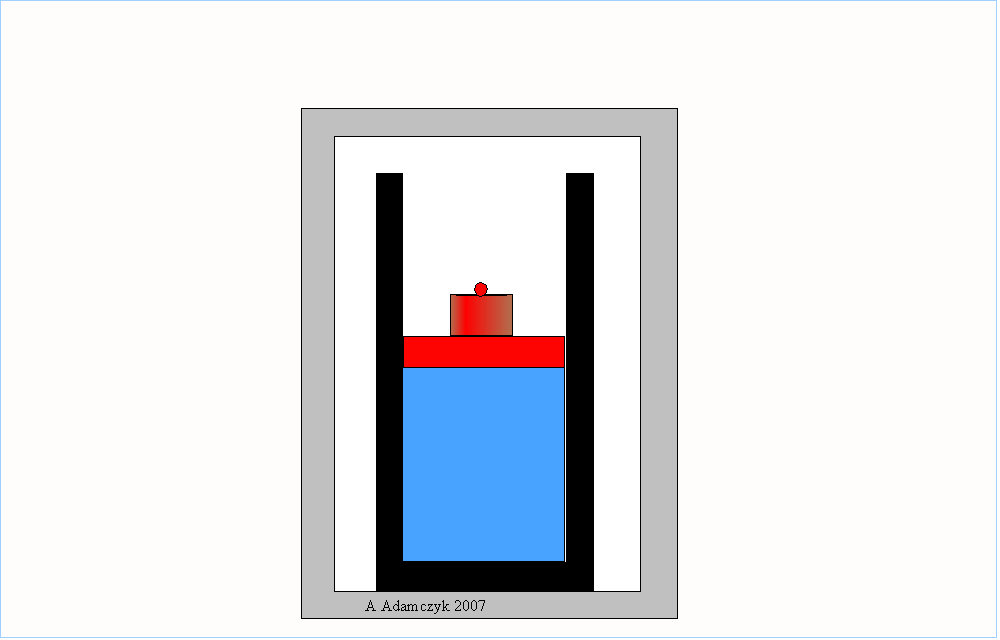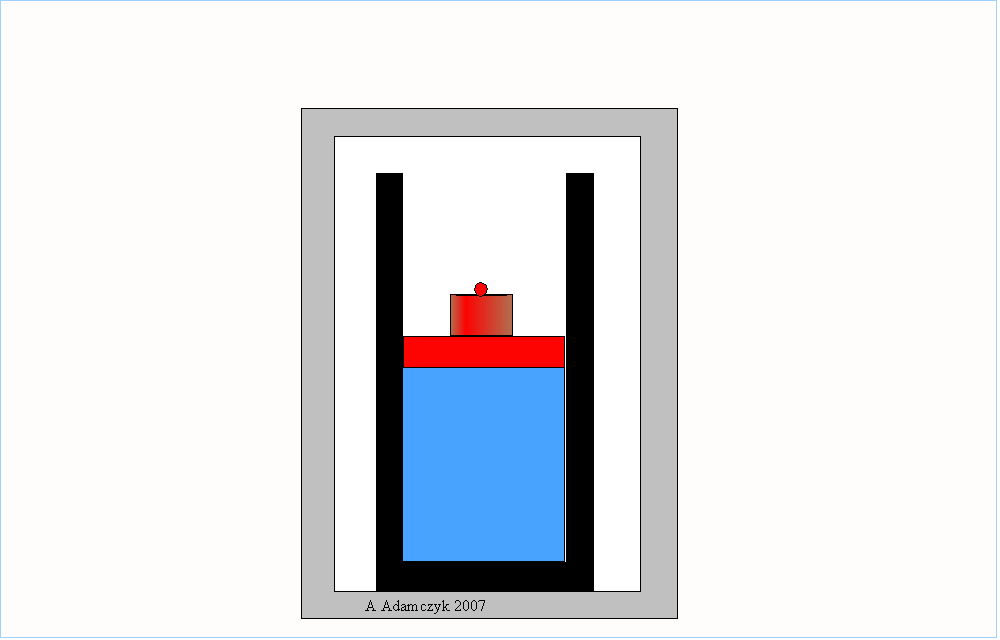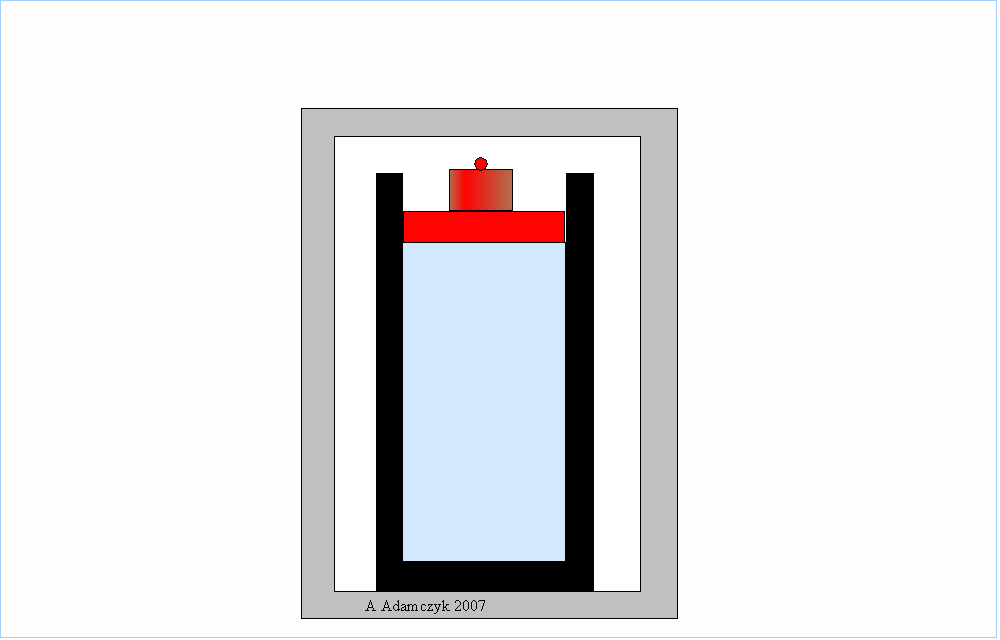
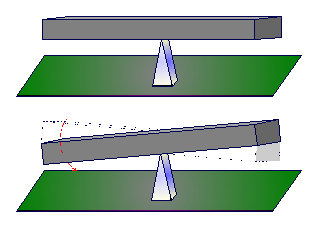
Aby roboczo odróżnić procesy odwracalne od nieodwracalnych możemy zastosować kryterium filmu: jeżeli sfilmujemy pewien proces i taki film odtworzymy w odwrotnym kierunku – od końca do początku – i jeżeli widownia nie zauważy wtedy niczego nadzwyczajnego to znaczy, że sfilmowaliśmy proces odwracalny.
Pojęcie procesów odwracalnych
jest jedynie wygodną idealizacją, ponieważ
w przyrodzie nie ma procesów ściśle
odwracalnych.
Biorąc pod uwagę fakt, że każdy z nas jest niezwykle
(nieomal nieskończenie) skomplikowanym układem termodynamicznym, to wszystko co
się wokół nas dzieje i każda nasze działanie (dobre lub złe) pozostawi w nas
ślad już na zawsze. Nic nigdy nie będzie takie, jak było i wszystko, co
robimy teraz ma już nieodwracalne skutki na nas i na nasze otoczenie.
Przedmiotem naszego kursu będą tylko proste procesy odwracalne. Termodynamika procesów nieodwracalnych (nierównowagowych) jest tak zaawansowana, że nie jest możliwe nawet pobieżne jej przedstawienie na kursie podstawowym.
Wybuchy jądrowe są przykładem spektakularnych procesów nieodwracalnych.

Jednak przyroda bije na głowę
wszystkie te fajerwerki dla dorosłych. Zwykła burza niesie energię tysiące razy
większą, niż bomba jądrowa. Jednak energia burzy rozładowuje się w czasie
kilkudziesięciu minut, a nie w ułamku sekundy jak to jest w przypadku bomby. Przypomnij
sobie, że moc jest prędkością wykonywania pracy, czyli prędkością uwalniania
energii! Zatem - w małym obszarze - wybuch ma moc większą niż burza, ale ma
energię zdecydowanie mniejszą.