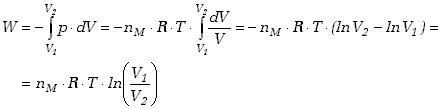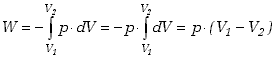Podstawowe procesy cieplne
Rozważmy kilka podstawowych procesów cieplnych (termodynamicznych).
Przemiana izochoryczna
|
Proces, w którym objętość układu pozostaje stała, czyli 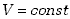 ,
nazywamy przemianą izochoryczną. W przemianie tej układ
nie wykonuje pracy nad otoczeniem, więc w oparciu o pierwszą zasadę
termodynamiki mamy dla przemiany izochorycznej relację ,
nazywamy przemianą izochoryczną. W przemianie tej układ
nie wykonuje pracy nad otoczeniem, więc w oparciu o pierwszą zasadę
termodynamiki mamy dla przemiany izochorycznej relację
|
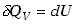 , ,
|
(7.18) |
co oznacza, że w przemianie izochorycznej możemy zmienić energię wewnętrzną
układu jedynie na drodze wymiany ciepła.
|
Pojemność cieplna substancji w procesie przebiegającym bez zmiany objętości
wyraża się wzorem
|
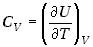
|
(7.19) |
gdzie indeks  przy znaku pochodnej cząstkowej oznacza, że proces zachodzi w stałej objętości.
Energia wewnętrzna danej masy gazu doskonałego zależy jednak wyłącznie od
temperatury. Przekonuje nas o tym doświadczenie J.P.Joule'a z rozprężaniem
rozrzedzonego gazu do próżni gdy układ jest w osłonie izolacyjnej uniemożliwiającej
wymianę ciepła z otoczeniem. Możemy wiec zapisać wzór (7.19) dla
gazu doskonałego w postaci
przy znaku pochodnej cząstkowej oznacza, że proces zachodzi w stałej objętości.
Energia wewnętrzna danej masy gazu doskonałego zależy jednak wyłącznie od
temperatury. Przekonuje nas o tym doświadczenie J.P.Joule'a z rozprężaniem
rozrzedzonego gazu do próżni gdy układ jest w osłonie izolacyjnej uniemożliwiającej
wymianę ciepła z otoczeniem. Możemy wiec zapisać wzór (7.19) dla
gazu doskonałego w postaci
|
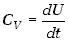
|
(7.20) |
czyli w dowolnym procesie kwazistatycznym, odwracalnym niezależnie jaka wielkość
jest stała zmiana energii wewnętrznej 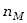 moli gazu doskonałego jest określona wzorem .
moli gazu doskonałego jest określona wzorem .
|
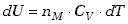
|
(7.21) |
Przemiana izotermiczna
Jeśli dany proces zachodzi w stałej temperaturze, czyli 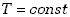 ,
to mówimy, że zachodzi przemiana izotermiczna. Z równania
stanu gazu wynika natychmiast, że w przemianie tej ciśnienie gazu jest
odwrotnie proporcjonalne do jego objętości, bowiem dla danej masy gazu wyrażonej
w molach mamy ,
to mówimy, że zachodzi przemiana izotermiczna. Z równania
stanu gazu wynika natychmiast, że w przemianie tej ciśnienie gazu jest
odwrotnie proporcjonalne do jego objętości, bowiem dla danej masy gazu wyrażonej
w molach mamy
|
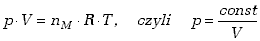
|
(7.22) |
Związek ten zwany jest prawem Boyle'a Mariotte'a.
|
Pracę wykonaną nad układem przy przemianie izotermicznej
wyznaczamy w oparciu o definicję (7.9) oraz korzystając z równania stanu dla
przemiany izotermicznej (7.22).
|
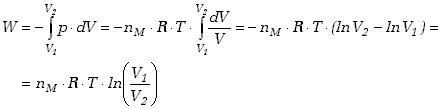
|
(7.23) |
Zapiszmy pierwsza zasadę termodynamiki dla przemiany izotermicznej w postaci
różniczkowej, wzór (7.8)
|
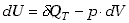 . .
|
(7.24) |
W przemianie izotermicznej T=const, więc dU=0 . Oznacza
to, że w przemianie tej układ ma ciągle taką samą energię wewnętrzną.
Widzimy dalej, że mimo iż temperatura układu jest stała, to jest wymieniane
ciepło między układem i otoczeniem. Ilość tego ciepła możemy określić w
oparciu o równanie (7.24)
|
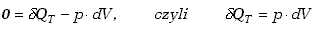
|
(7.25) |
co określa, uwzględniając zmianę znaku, wyrażenie (7.23). Jeśli
praca jest wykonywana nad układem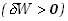 , to ciepło w równej ilości musi być oddawane do otoczenia
, to ciepło w równej ilości musi być oddawane do otoczenia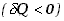 i
vice versa.
i
vice versa.
Przemiana izobaryczna
|
Jeśli proces zachodzi pod stałym ciśnieniem, czyli 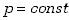 ,
to mówimy, że zachodzi przemiana izobaryczna. Układ
wykonuje dodatnią prace nad otoczeniem W'- rozszerzając się lub
ujemną - kurcząc się. Ciśnienie zachowuje stałą wartość więc praca
wykonana nad układem w przemianie izobarycznej wynosi ,
to mówimy, że zachodzi przemiana izobaryczna. Układ
wykonuje dodatnią prace nad otoczeniem W'- rozszerzając się lub
ujemną - kurcząc się. Ciśnienie zachowuje stałą wartość więc praca
wykonana nad układem w przemianie izobarycznej wynosi
|
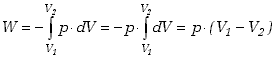
|
(7.26) |
|
Podwyższenie temperatury o jeden stopień wymaga więcej ciepła niż w
przypadku ogrzewania bez zmiany objętości, bowiem część ciepła zużywana
jest na wykonanie pracy.
|
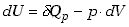
|
(7.27) |
Wyrażenie to możemy przepisać w innej postaci wykorzystując wzór (7.20)
|
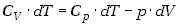
|
(7.28) |
gdzie wprowadziliśmy pojęcie ciepła molowego przy stałej objętości
|
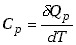
|
(7.29) |
Z równania (7.28) wynika, że w procesie izobarycznym zmieniają się
wszystkie funkcje termodynamiczne, a więc energię wewnętrzna możemy zmienić
zarówno na drodze wykonania pracy jak i wymiany ciepła.
Różniczkując równanie stanu gazu dla procesu izobarycznego, gdzie 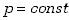 mamy
mamy
|
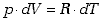
|
(7.30) |
Wykorzystując ten związek możemy równanie (7.28) przepisać, po
podzieleniu przez 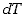 ,
w postaci
,
w postaci
|
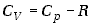
|
(7.31) |
Stosunek ciepła właściwego przy stałym ciśnieniu do ciepła właściwego
przy stałej objętości stanowi charakterystykę danego gazu i oznaczany jest
zwykle symbolem 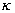 (kappa).
(kappa).
|
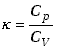
|
(7.32) |
Wykorzystując wzór (7.31) mamy związek
|
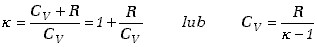
|
(7.33) |
![]() ,
nazywamy przemianą izochoryczną. W przemianie tej układ
nie wykonuje pracy nad otoczeniem, więc w oparciu o pierwszą zasadę
termodynamiki mamy dla przemiany izochorycznej relację
,
nazywamy przemianą izochoryczną. W przemianie tej układ
nie wykonuje pracy nad otoczeniem, więc w oparciu o pierwszą zasadę
termodynamiki mamy dla przemiany izochorycznej relację