| Atom wodoropodobny |
Model atomu Bohra opisywał widmo atomu wodoru, czyli atomu posiadającego tylko jeden elektron. Próby opisu w ramach tego samego podejścia widma atomu helu o dwóch elektronach nie dały wyników zgodnych z obserwacjami doświadczalnymi. Nie było też możliwe określenie w ramach tego formalizmu względnego natężenia linii widmowych, można było jedynie określić ich położenie.
Zasadniczym jednak niedostatkiem modelu Bohra była jego wewnętrzna niespójność. Model zawiera elementy klasyczne i wprowadzone "ad hoc" elementy kwantowe; nie stanowi więc konsekwentnej teorii. Zaletą tego modelu było więc przede wszystkim uzmysłowienie potrzeby stworzenia nowej teorii, opartej na innych zasadach niż zasady fizyki klasycznej. Taką teorią jest mechanika kwantowa, której podstawowym równaniem jest równanie Schrödingera.
Zapiszmy zasadnicze cechy rozwiązania Równanie Schrodingera dla atomów wodoropodobnych,
tzn. posiadających jeden elektron.
Ładunek jądra atomowego w takich atomach może być większy; oznaczymy go
jako +Ze. Kiedy Z=1, mamy do czynienia z atomem wodoru,
kiedy jest większe, rozważamy zjonizowany atom czyli jon.
Nie będziemy tu przytaczać szczegółów rozwiązywania tego równania.
Wymaga ono wykonania szeregu kroków pośrednich i podstawień, zaś rozwiązania
wyrażają się przez funkcje specjalne w postaci szeregów. Ważne jest, że tzw. funkcje
własne tego równania mają postać iloczynu funkcji zależnych od poszczególnych
współrzędnych w układzie sferycznym tj. takim, gdzie położenie punktu okreslone jest
przez wartość promienia i dwóch kątów tj:
![]() .
.
| (4.1.1) |
Występujące tu parametry: n, l, m noszą nazwę liczb kwantowych odpowiednio: głównej, orbitalnej lub azymutalnej i magnetycznej. Liczby te przybierać mogą wartości:
| główna liczba kwantowa: | ||||
| orbitalna liczba kwantowa: | (4.1.2) | |||
|
magnetyczna liczba kwantowa: |
Liczby te (i warunki na ich możliwe wartości) pojawiają się jako indeksy numerujące poszczególne, dopuszczalne matematyczne rozwiązania równania Schrödingera. Jak zobaczymy niżej, pojawiają się one w wyrażeniach na fizyczne wielkości określające stan kwantowy elektronu w atomie, kwantując ich wartości. W ten sposób ze zwykłych indeksów matematycznych stają się fizycznymi liczbami kwantowymi.
Główna liczba kwantowa określa energie stanów związanych elektronu w atomie wodoropodobnym. Energie te mają wartości ujemne i wynoszą
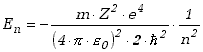 |
(4.1.3) |
Jest to dokładnie to samo wyrażenie, które uzyskał Bohr w swych warunkach na kwantyzacje orbit elektronowych. Tu jednak, wyrażenie to otrzymuje się jako rezultat rozwiązania podstawowego równania mechaniki kwantowej, które równocześnie opisuje cały szereg innych zagadnień i nie wymaga dodatkowych założeń. Dodajmy, że możliwe są również rozwiązania równania Schrödingera o dowolnych dodatnich wartościach energii. Odpowiada to przypadkowi rozproszenia elektronu, który najpierw przybliża się, a potem oddala od jądra atomowego, a także elektronowi uwolnionemu z wiązania w atomie po jego jonizacji, czyli elektronowi swobodnemu..
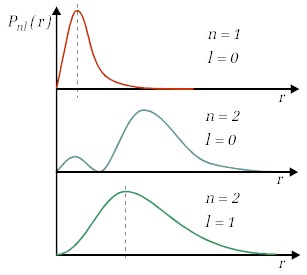 |
Dodajmy również, że w wyniku rozwiązania równania Schrödingera otrzymujemy także wyrażenia określające postać funkcji falowych, których kwadrat modułu, jak wiemy, pozwala określić prawdopodobieństwo znalezienia elektronu w danym obszarze przestrzennym. W przypadku ujemnych wartości energii, które odpowiadają stanom związanym elektronu, uzyskujemy rozkład prawdopodobieństwa znalezienia elektronu względem położenia jądra atomowego. Przykłady rozkładów w funkcji odległości od jądra (radialna gęstość prawdopodobieństwa) dla kilku pierwszych wartości n oraz l pokazuje Rys.4.1.1. Na rysunku tym linią przerywaną zaznaczone są położenia maksimów gęstości prawdopodobieństwa dla wartości l=lmax= n-1. Wartości r odpowiadające tym maksimom równe są wartościom promieni orbit elektronów określonych przez Bohra. Widzimy jednak, że zgodnie z mechaniką kwantową położenia te są "rozmyte"; nie są stałymi wartościami. |
| Rys.4.1.1. Gęstość prawdopodobieństwa znalezienia elektronów w funkcji odległości od jądra dla kilku wartości liczb n i l. |
Zwróćmy uwagę na zasadniczą różnicę w podejściu klasycznym i kwantowym. Model Bohra przypominał układ planetarny z określonymi orbitami elektronów. W mechanice kwantowej nie ma żadnych orbit; jest rozkład prawdopodobieństwa. Trzeba jednak "oddać sprawiedliwość" Bohrowi, bo maksymalne gęstości prawdopodobieństwa wyznaczane przez mechanikę kwantową odpowiadają przewidzianym przez niego promieniom orbit. Elektron jednak wcale nie musi znajdować się w odległości od jądra równej promieniowi orbity Bohra. Najlepiej więc nie mówić o położeniu elektronu ale o rozkładzie prawdopodobieństwa położenia. Mówimy raczej o "chmurze elektronowej" wokół jądra, a nie o elektronie krążącym po orbicie
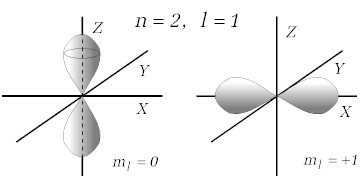 |
Gdy orbitalna liczba kwantowa l nie jest równa
zeru, rozkład prawdopodobieństwa znalezienia elektronu w przestrzeni wokół jądra
nie ma symetrii sferycznej. Przestrzenny rozkład prawdopodobieństw dla różnych
kombinacji liczb kwantowych nosi nazwę orbitali. Rysunek 4.1.2 pokazuje
dwa przykłady orbitali dla podanych tam kombinacji liczb kwantowych.
Rys.4.1.2. Przykłady orbitali dla n=2 i l=1. |
Całkowita energia atomu, określona wzorem (4.1.3) zależy wyłącznie od głównej liczby kwantowej n. Funkcje własne są jednak zależne także od l i ml. Oznacza to, że tej samej energii może odpowiadać kilka różnych stanów określonych różnymi wartościami tych liczb. Mówimy, że w takim przypadku funkcje własne są zdegenerowane, a takie stany atomu nazywamy zdegenerowanym lub zwyrodniałymi. Stopień lub krotność degeneracji ze względu na daną liczbę kwantową określa liczba stanów własnych odpowiadających danej wartości tej liczby. Liczba stanów odpowiadających tej samej wartości liczby n równa jest n stanom liczny kwantowej l mnożonym przez (2l+1) stanów liczmy kwantowej ml czyli jest to suma postaci
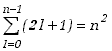 |
(4.1.4) |
Mówimy, że krotność degeneracji poziomów energetycznych wynosi w tym przypadku n2. Stany o różnych wartościach orbitalnej liczby kwantowej mają tę samą energię ale różnią się wartością momentu pędu. Stanom tym przyporządkujemy symbole literowe,
 |