| Struktura atomu |
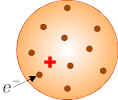
Pierwszy model opisujący strukturę atomu należy do J.J. Thomsona, który zakładał, że atom zajmuje pewien obszar o symetrii kulistej i promieniu rzędu 10-10m wypełniony w sposób ciągły ładunkiem dodatnim, Rys.3.4.1.
 |
Elektrony rozmieszczone są w tym dodatnio naładowanym obszarze w sposób jednorodny, co stanowi rezultat ich wzajemnego odpychania się. Czasami nazywa się żartobliwie taki model atomu modelem "pączka z rodzynkami", w którym ciasto stanowi materia dodatnio naładowana, a rodzynkami są elektrony. Wzbudzenia termiczne atomów i wysyłanie przez nie promieniowania wynikało tu z faktu, że elektrony mogą wykonywać drgania w rezultacie czego, emitowane jest promieniowanie elektromagnetyczne zgodnie z teorią Maxwella. Odzwierciedlało to jakościowo obserwacje doświadczalne, ale nie zgadzało się ilościowo z wynikami pomiarów. |
| Rys.3.4.1. Model atomu Thomsona |
Model Thomsona zachowuje swą rolę w historii rozwoju naszej wiedzy o budowie atomów, ale obecnie wiadomo, że nie odpowiada on rzeczywistości. Doświadczeniem, które pokazało niezgodność modelu Thomsona z wynikami pomiarów był eksperyment wykonany przez Rutherforda w 1911 roku.
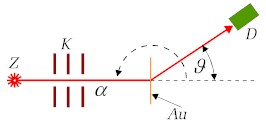 |
Schemat doświadczenia Rutherforda ilustruje Rys.3.4.2. W
eksperymencie tym cząstki |
| Rys.3.4.2. Schemat doświadczenia Rutherforda |
Gdyby cząstki ![]() rozpraszane były na atomach o strukturze odpowiadającej modelowi Thomsona, to
prawdopodobieństwo rozproszeń pod dużymi kątami
rozpraszane były na atomach o strukturze odpowiadającej modelowi Thomsona, to
prawdopodobieństwo rozproszeń pod dużymi kątami ![]() byłoby bardzo niewielkie ze względu na równomiernie rozłożony ładunek
dodatni w całej objętości atomu. (Rozproszenia na elektronach można zaniedbać
ze względu na ich bardzo małą masę w stosunku do masy cząstki
byłoby bardzo niewielkie ze względu na równomiernie rozłożony ładunek
dodatni w całej objętości atomu. (Rozproszenia na elektronach można zaniedbać
ze względu na ich bardzo małą masę w stosunku do masy cząstki ![]() .)
W doświadczeniu obserwowano jednak błyski świetlne także pod dużymi kątami
włączając w to rozproszenia "do tyłu" czyli pod kątami większymi
niż 90o, co było zupełnie nieprawdopodobne w ramach
modelu Thomsona.
.)
W doświadczeniu obserwowano jednak błyski świetlne także pod dużymi kątami
włączając w to rozproszenia "do tyłu" czyli pod kątami większymi
niż 90o, co było zupełnie nieprawdopodobne w ramach
modelu Thomsona.
|
Rutherford założył,
że cały dodatni ładunek atomu i prawie cała jego masa skupione są w bardzo
małym obszarze zwanym jądrem atomowym. Rozproszenia cząstek |
Nie rozwiązało to jednak wszystkich problemów. Konsekwentne rozumowanie na gruncie podejścia klasycznego prowadzi do wniosku, że jeśli elektrony znajdują się w spoczynku, to wskutek przyciągania elektrostatycznego powinny maksymalne zbliżyć się do jądra wskutek czego rozmiary atomu i jądra powinny być podobne. Przeczy to jednak wynikom doświadczeń. Chcąc zapobiec "spadaniu" elektronów na jądro, można przyjąć założenie, że krążą one wokół jądra przyciągane siłami elektrostatycznymi, które równoważy siła odśrodkowa, analogicznie jak planety krążą wokół Słońca przyciągane siłami grawitacji. Siła odśrodkowa równoważy przyspieszenie dośrodkowe, jakiego doznaje elektron na orbicie wokół jądra. Kiedy jednak elektron, będąc cząstką naładowaną, jest w ruchu przyspieszonym, to powinien wypromieniowywać energię zgodnie z teorią Maxwella. Gdyby wypromieniowywał energię, wysyłając falę elektromagnetyczną, to jego energia na orbicie ulegałaby zmniejszeniu i w końcu także "wylądowałby" na jądrze atomowym. Widać, że w ramach podejścia klasycznego nie da się opisać własności atomu.
Problem "spadania elektronów" zawierał w sobie jeszcze jedną zagadkę. Widmo energetyczne promieniowania elektromagnetycznego emitowanego w trakcie "spadania" powinno mieć charakter ciągły. Tymczasem obserwowane widma promieniowania świetlnego emitowanego przez gazy w wyładowaniach elektrycznych miały charakter nieciągły - stanowiły serie prążków. Zaobserwowano, ze widma te są różne dla różnych pierwiastków. (Ta bardzo użyteczna własność stanowi podstawę tzw. analizy widmowej umożliwiającej identyfikacje nawet śladowych zawartości danego pierwiastka w badanej próbce.) Widma różnych pierwiastków maja na ogół dość skomplikowaną strukturę, ale charakterystyczną dla danego pierwiastka.
Najprostsze jest widmo promieniowania wodoru. W obszarze światła widzialnego długość fali tego widma może być opisana wzorem podanym przez szwajcarskiego fizyka Balmera
|
|
(3.4.1) |
Wykryto także szereg innych serii linii widmowych w obszarze podczerwieni i nadfioletu. Opisane one zostały w jednolity sposób przez Rydberga, który wyrażał je używając odwrotności długości fali tzw. liczby falowej.
|
|
(3.4.2) |
Zapisana w ten sposób seria linii widmowych Balmera ma postać
|
|
(3.4.3) |
gdzie ![]() jest stałą
Rydberga dla wodoru , która wynosi
jest stałą
Rydberga dla wodoru , która wynosi
|
|
(3.4.4) |
i która, jak widać, została wyznaczona niezwykle precyzyjnie.
Serie widmowe atomu wodoru mogą być przedstawione za pomocą wzoru
|
|
(3.4.5) |
gdzie liczba ![]() identyfikuje nazwę serii: Lymana (m=1), Balmera (m=2),
Paschena (m=3), Bracketta (m=4), Pfunda (m=5).
identyfikuje nazwę serii: Lymana (m=1), Balmera (m=2),
Paschena (m=3), Bracketta (m=4), Pfunda (m=5).
W przypadku pierwiastków alkalicznych (Li, Na, K, ...) można także opisać postać serii widmowych stosunkowo prostym wzorem
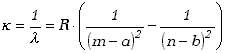 |
(3.46) |
W tym przypadku R jest stałą Rydberga dla danego pierwiastka, a stałe a i b przypisane są poszczególnym seriom. Liczba m ma wartość całkowitą i stałą dla danej serii, a n zmienia się podobnie jak we wzorze (3.4.5). Zaobserwowane prawidłowości stanowią bardzo wartościową informację, ale wciąż nie wiadomo, dlaczego reguły podane wyżej są właśnie takie.