WODA
Strukturę molekuł wody można przedstawić za pomocą symbolicznych profili rozkładu chmur elektronowych w powiązanych ze sobą atomach tlenu i wodoru.

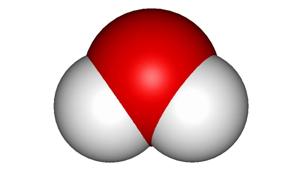
Gęstość ładunku elektronowego jest mniejsza w pobliżu atomów H (atom tlenu „odsysa” ładunek elektronowy z otoczenia atomów wodoru).
Woda jest
jedną z najbardziej interesujących substancji w przyrodzie. Swoje zadziwiające
własności zawdzięcza dwom cechom:
a) silnej
polarności molekuły H2O
b) zdolności do
wiązań wodorowych.
Zwłaszcza ten drugi czynnik jest powodem szczególnej roli,
jaką woda spełnia w przyrodzie. Bez wiązań wodorowych woda miała by zupełnie
inne własności fizyczne. Można je przewidywać na podstawie tzw. zasady
podobieństwa. Analizie poddaje się pierwiastki należące do tej samej podgrupy
tlenowców VI grupy układu okresowego Mendelejewa: O, S, Se i Te. Spośród tych
pierwiastków, tylko tlen ma zdolność do tworzenia wiązań wodorowych. Badany
jest przebieg zmian własności fizycznych wraz ze zmianą masy atomowej
pierwiastków wewnątrz grupy i na podstawie charakteru tych zmian wnioskuje się
o własnościach, jakie "powinna" mieć woda, gdyby nie występowały w
niej wiązania wodorowe. W tabeli poniżej przedstawiono niektóre własności
analogów H2O a przewidywane wartości dla wody umieszczono w
nawiasach.
|
VI |
Związek |
Wzór |
Masa cząst. |
Temp.
wrzenia ºC |
Temp. topn. ºC |
|
52Te128 |
Tellurowodór |
H2Te |
130 |
-4 |
-51 |
|
34Se79 |
Selenowodór |
H2Se |
81 |
-42 |
-61 |
|
16S32 |
Siarkowodór |
H2S |
34 |
-61 |
-82 |
|
8O16 |
"Tlenowodór" |
H2O |
18 |
+100 (oczekiwane -70) |
0 (oczekiwane -90) |
Wiązania
wodorowe powodują powstanie otwartych struktur także i w ciekłej wodzie. Takie
struktury pojawiają się jako wynik przestrzennego rozbudowania stosunkowo
stabilnej formy cyklicznego pentameru powstającego z molekuł wody przez
wytworzenie wiązań wodorowych.
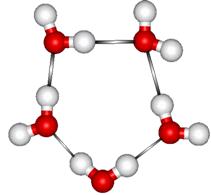
Dalsza rozbudowa tego pentameru prowadzi do powstania trójwymiarowych cyklicznych oktamerów, dekamerów itd. Struktury przestrzenne, powstające w wodzie w wyniku wiązań wodorowych są tworzone bardzo dynamicznie. Średni czas trwania wiązania wodorowego w wodzie w temperaturze pokojowej wynosi 3×10-12 s (3 ps) co oznacza, że jedne struktury się rozpadają ale natychmiast tworzą się nowe. Formy strukturalne wody utworzone pod działaniem wiązań wodorowych są bardzo bogate. Ich obszerny przegląd wraz ze szczegółowym opisem własności wody można znaleźć na stronie:
http://www.martin.chaplin.btinternet.co.uk/index.html
Rezultatem istnienia wiązań wodorowych w wodzie jest pojawienie się ok. 40 nadzwyczajnych własności wody, 12 struktur lodu i wiele struktur klatratowych (tzw. hydratów gazowych) powstałych z wychwycenia przez wodę obcych molekuł, np. gazów szlachetnych (za wyjątkiem He, który jest zbyt mały), NH4+, H3O+, Cs+, N2, O2, CH4, H2S, CO2, C2H6 oraz C3H8..
Normalny lód ma strukturę heksagonalną ale lód z wychwyconymi molekułami tworzy dwie odmienne struktury, z których jedna może zamknąć tylko małe molekuły gazów, takich jak metan (rysunek poniżej) i inne o podobnych rozmiarach. Struktura drugiego typu duże wnęki, mogące pomieścić nawet stosunkowo długie łańcuchy węglowodorów.
Hydraty gazowe zawierają bardzo dużą ilość gazu; stopienie 1cm3 hydratu metanu powoduje uwolnienie do 164 cm3 metanu. Woda pochodząca z topnienia hydratu jest wodą słodką, podobnie jak woda ze zwykłego lodu.
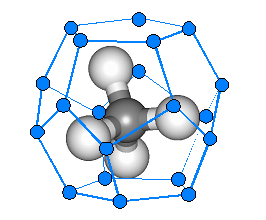
|
W hydratach gazów cząsteczki zamarzniętej wody tworzą klatki w kształcie dwunastościanów, w których zamknięte są cząsteczki gazów, takich jak metan lub siarkowodór. (HYDRAT.WPG) |
40 Osobliwych własności wody
http://www.martin.chaplin.btinternet.co.uk/index.html
1. Wysoki punkt topnienia (0°C, por. CHCl3
-63°C)
W lodzie wszystkie molekuły wody są zaangażowane w czterech wiązaniach
wodorowych (dwie jako donory i dwie jako akceptory). W ciekłej wodzie niektóre
wiązania wodorowe muszą zostać zerwane co wymaga dostarczenia sporej energii.
2. Wysoka temperatura wrzenia (100°C, por. CHCl3 61°C)
Wiązania wodorowe istniejące w ciekłej wodzie utrudniają jej molekułom
opuszczenie objętości cieczy co obniża ciśnienie pary nasyconej. To ciśnienie
musi być równe ciśnieniu zewnętrznemu aby nastąpiło wrzenie.
3. Wysoki punkt krytyczny (374°C, por. CH3CH3
32°C)
Punkt krytyczny może być osiągnięty tylko wtedy, gdy oddziaływania między
molekułami wody spadną poniżej pewnej wartości progowej. Wiązania wodorowe,
których ilość jest duża nawet w wysokich temperaturach, przeciwdziałają
zmniejszaniu się sumarycznej energii oddziaływań.
4. Wysokie napięcie
powierzchniowe (72.75 mJ/m2, por. CCl4 26.6 mJ/m2 przy 20°C)
Wiązanie wodorowe energicznie wciąga molekuły wody do wnętrza co zwiększa
energię potrzebną do wytworzenia powierzchni swobodnej.
5. Wysoka lepkość (0.89 cP, por. pentan 0.22 cP, przy 25°C))
Duża kohezja molekuł wody ograniczająca łatwość ich wzajemnego przesuwania się
jest wywołana przez istnienie trójwymiarowych sieci wiązań wodorowych.
6. Wysokie ciepło
parowania (40.7 kJ mol-1, por. H2S 18.7 kJ mol1)
Znowu efekt działania wiązań wodorowych.
7. Woda kurczy się przy topnieniu Tetraedryczne struktury utworzone przez wiązania wodorowe w zwykłym lodzie (heksagonalnym) zapadają się w wyniku topnienia.
8. Woda ma dużą gęstość, która
rośnie przy ogrzewaniu od 0°C do 3.984°C
Wynik kohezyjnego działania wiązań wodorowych. Wzrost gęstości wody wraz ze
wzrostem temperatury jest skutkiem zapadania sie dwudziestościennych klasterów
i tworzenia obszarów o gęstszym upakowaniu.
9. Liczba najbliższych sąsiadów molekuły wody zwiększa się przy topnieniu W zwykłym lodzie (heksagonalnym) każda molekuła wody ma czterech najbliższych sąsiadów. Zapadanie się takiej otwartej struktury przy topnieniu zwiększa liczbę sąsiadujących molekuł.
10. Liczba najbliższych sąsiadów molekuł zwiększa się także przy ogrzewaniu wody. Ze wzrostem temperatury maleje ilość klasterów utworzonych w wyniku wiązań wodorowych co powoduje dalszy wzrost liczby sąsiadujących molekuł.
11. Wzrost ciśnienia obniża temperaturę topnienia (13.35 MPa obniża punkt topnienia do -1°C)
12. Ciśnienie obniża
temperaturę, przy której woda osiąga maksymalną gęstość
13. D2O oraz T2O różnią się znacznie swoimi własnościami fizycznymi od H2O dużo bardziej niż można by oczekiwać na podstawie ich wzrastających mas; np. temperatury ich maksymalnej gęstości wzrastają odpowiednio do 11.185°C i do 13.4°C. W tych cięższych związkach wiązania wodorowe są znacznie silniejsze.
14. Lepkość rośnie bardzo szybko z obniżaniem temperatury
15. Lepkość maleje ze wzrostem ciśnienia (w temperaturach poniżej 33°C)
16. Woda ma niską ściśliwość (0.46
GPa-1, por. CCl4 0.92 GPa-1, w 20°C)
17. Ściśliwość wody maleje ze
wzrostem temperatury aż do wartości minimalnej w temperaturze ok. 46.5°C. Oznacza to, że poniżej tego
punktu woda staje się łatwiejsza do ściśnięcia wraz z obniżaniem temperatury
18. Woda ma mały
współczynnik rozszerzalności termicznej (0.00021/°C, por. CCl4
0.00124/°C w 20°C)
19. Współczynnik rozszerzalności termicznej wody stopniowo maleje z obniżaniem temperatury aż staje się ujemny w niskich temperaturach. Przechłodzona i zimna (poniżej 3.984°C) ciekła woda kurczy się przy ogrzewaniu.
20. Prędkość dźwięku w wodzie
rośnie wraz ze wzrostem temperatury (aż do wartości maksymalnej przy 73°C)
21. Ciepło właściwe wody jest
ponad dwukrotnie większe niż ciepło właściwe lodu lub pary wodnej (por.
benzen gdzie CP cieczy = 1.03 x CP kryształu)
22. Ciepło właściwe wody (CP
oraz CV) jest wysokie (CV i CP, 4.18 J
g-1 K-1) np. pentan 1.66 J g-1 K-1,
w 25°C)
23. Ciepło właściwe CP
ma minimum przy 36°C
24. Czasy relaksacji spin-sieć
w rezonansie NMR są bardzo małe w niskich temperaturach
25. Substancje rozpuszczone w wodzie wykazują specyficzny wpływ na takie własności roztworu jak gęstość i lepkość. Substancje rozpuszczone będą wpływały na równowagę klasterów molekularnych przez faworyzowanie albo struktur otwartych albo zapadniętych.
26. Żaden z roztworów wodnych nawet nie zbliża się do idealności termodynamicznej (nie może być traktowany jako roztwór idealny); nawet roztwory HDO i D2O w H2O nie są idealne
27. Widmo dyfrakcji promieniowania rentgenowskiego w wodzie wykazuje niezwykle zróżnicowaną strukturę. Można to objaśnić istnieniem uporządkowanych klasterów molekularnych w fazie ciekłej.
28. Przechłodzona woda ma dwie fazy i drugi punkt krytyczny
przy ok. -50oC.
29. Ciekła woda może być przechłodzona, w postaci małych
kropelek, aż do ok. -70oC. Przechłodzona woda może być także
otrzymana ze szklistego lodu amorficznego w temperaturach między -123oC
i -149oC i może współistnieć z lodem o strukturze kubicznej aż do
-63oC
30. Zestalona woda występuje w postaci różnorodnych
struktur krystalicznych (stabilnych lub metastabilnych) oraz amorficznych
31. Gorąca woda może zamarzać szybciej niż zimna; tzw.
efekt Mpemba
32. Współczynnik załamania wody ma wartość maksymalną tuż poniżej 0°C. Współczynnik załamania wody (λ = 589.26 nm) wzrasta od oszacowanej wartości 1.33026 przy -30°C do wartości maksymalnej tuż poniżej 0°C (1.33434) przed równomiernym spadkiem do 1.31854 przy 100°C.
33.
Rozpuszczalności gazów niepolarnych w wodzie zmniejszają się wraz ze wzrostem
temperatury do pewnej wartości minimalnej, a następnie znowu rosną
34. Przy niskich temperaturach samodyfuzja wody wzrasta
wraz ze wzrostem gęstości i ciśnienia.
35. Przewodnictwo cieplne wody wzrasta do wartości
maksymalnej przy ok. 130°C, a następnie spada
36. Ruchliwości jonów H+ i OH- w polach elektrycznych są anomalnie duże, odpowiednio 362 and 206 (nm s-1)/(V m-1) at 25°C w porównaniu z wartościami dla innych małych jonów, jak jon litu (40(nm s-1)/(V m-1)) i jon fluoru (57(nm s-1)/(V m-1)).
37. Ciepło topnienia przechłodzonej wody ma wartość
maksymalną przy -17°C
38 Względna przenikalność elektryczna (stała dielektryczna) wody jest wysoka (78.4 przy 25°C). Molekuły polarne, gdzie środki ładunków dodatnich i ujemnych są rozdzielone, mają trwały moment dipolowy. Oznacza to, że w przyłożonym polu elektrycznym molekuły polarne dążą do ustawienia się wzdłuż tego pola. Chociaż woda jest molekułą polarną, to sieć wiązań wodorowych przeciwstawia się takiemu ustawieniu. Stopień, w jakim substancja dokonuje takiego ustawienia się jest nazywana jej stałą dielektryczną, a ponieważ woda jest wyjątkowo spoista (kohezyjna) to ma ona wysoką stałą dielektryczną. Pozwala to wodzie działać jak rozpuszczalnik dla związków jonowych, gdzie przyciągające pole elektryczne między przeciwnie naładowanymi jonami jest zredukowane o około 80-razy, pozwalając na przejście w ruchu termicznym rozdzielonych jonów do roztworu. Przy ogrzewaniu stała dielektryczna spada i ciekła woda staje się daleko mniej polarna aż do wartości około 6 w punkcie krytycznym. Ta stała dielektryczna jest w podobny sposób redukowana jeżeli wiązanie wodorowe jest rozrywane w jakiś inny sposób, taki jak silne pola elektryczne. Być może, że ta własność wody nie powinna być traktowana jako anomalna, jako że inne małe molekuły polarne tworzą ciecze mające również wysokie stałe dielektryczne (np. stała dielektryczna ciekłego HCN wynosi 158).
39. Woda ma obojętny charakter kwasowo-zasadowy (pH = 7) i
zachowuje przy tym własności znakomitego rozpuszczalnika. Obecność wody
modyfikuje strukturę trzeciorzędową białek, decydującą o funkcjonalności białek
w komórkach biologicznych i poza nimi
40. Istnienie wiązań wodorowych w wodzie powoduje
powstawanie struktur otwartych („klatek”), w których mogą być
zamykane obce molekuły tworząc hydraty
Energia oddziaływań substancji
rozpuszczonej z rozpuszczalnikiem
(solute-solvent interactions)
Oddziaływania
substancji rozpuszczonej z rozpuszczalnikiem są mieszaniną oddziaływań
elektrycznych i dyspersyjnych.
Obowiązuje zasada “swój do swego”, co oznacza, że substancje polarne rozpuszczają się w rozpuszczalnikach polarnych (sól w wodzie), a substancje niepolarne rozpuszczają się w rozpuszczalnikach niepolarnych (oliwa w benzenie).
Struktura wody ulega zmianie pod wpływem substancji w niej
rozpuszczonych. Szczególnie wyraźnie zjawisko to przebiega w roztworach
elektrolitów, czyli substancji, które w wodzie ulegają dysocjacji na jony.
Każdy z powstałych jonów otacza się kulą dipolowych molekuł wody, czyli - jak
mówimy - ulega solwatacji (hydratacji). Warstwa wody, otaczająca jon nosi nazwę otoczki
solwatacyjnej. Jony w wodzie poruszają się teraz wraz ze swoją chmurą
solwatacyjną i tylko w wyniku silnej fluktuacji mogą zostać z niej wyrzucone.
Natychmiast, zresztą, tworzą nową otoczkę solwatacyjną.
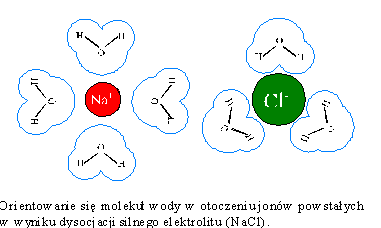
Otoczki
solwatacyjne bardzo silnie wpływają na przebieg reakcji elektrodowych, a także
na mechanizm przewodzenia prądu w roztworach elektrolitów. Jon, otoczony chmurą
molekuł wody, po dotarciu do elektrody musi oswobodzić się ze swej otoczki
solwatacyjnej zanim wejdzie w reakcję elektrodową. Mechanizm ten jest źródłem
dodatkowej impedancji elektrodowej.
Działanie otoczki solwatacyjnej jest powodem tajemniczego, do niedawna, zjawiska. Jest nim występowanie maksimum na krzywej przewodnictwa roztworów silnych elektrolitów, mierzonego w funkcji stężenia roztworu. Należy pamiętać, że takie elektrolity, jak NaCl, NaOH i H2SO4 są w roztworach wodnych całkowicie zdysocjowane i wraz ze wzrostem ich stężenia, rośnie także ilość nośników prądu. Nic więc dziwnego, że w początkowym zakresie stężeń przewodnictwo roztworu wzrasta wraz z ilością rozpuszczonego elektrolitu. Jednakże, jak widać na rys. 5., po przekroczeniu pewnej wartości stężenia, przewodnictwo zaczyna maleć, mimo, że rośnie ilość nośników. Zjawisko to wydawało się całkowicie niezrozumiałe i mało które wykresy wywołały tyle dyskusji, co owe "krzywe z garbem". Mówi się, że tradycyjne i uporządkowane wyobrażenia o roztworach elektrolitów "runęły pod ciężarem krzywych z garbem".
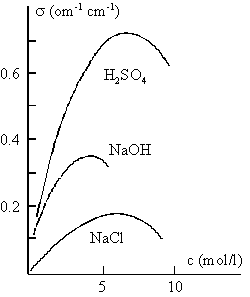
Zależność przewodnictwa roztworów elektrolitów od stężenia
(„krzywe z garbem”)
Oddziaływania substancji amfifilowych z
rozpuszczalnikiem.
Molekuły amfifilowe zbudowane z dwóch części – jednej polarnej, mającej silne powinowactwo do rozpuszczalników polarnych (np. wody) i drugiej niepolarnej (zwykle łańcucha alkilowego) mającej powinowactwo do rozpuszczalników niepolarnych (zasada „swój do swego”). Typowymi przykładami takich molekuł amfifilowych są kwasy tłuszczowe i zwykłe mydła (sole tych kwasów).
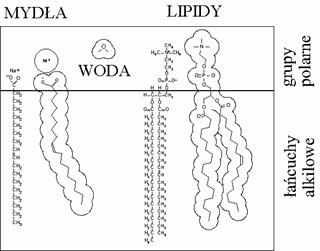
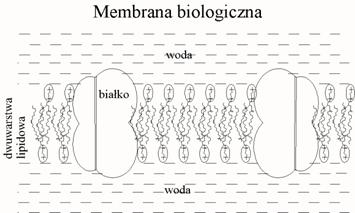
W połączeniu z wodą substancje amfifilowe mogą tworzyć dwa bardzo ważne typy warstw – membrany biologiczne i błony mydlane. Membrany biologiczne są utworzone przez dwuwarstwę lipidową rozdzielające dwa obszary wodne, które stabilizują całą strukturę. Dwuwarstwa lipidowa w środowisku wodnym stanowi jednocześnie matrycę, w której umieszczone są molekuły białek.
Błony mydlane mają strukturę odwrotną do struktury membran biologicznych – tutaj warstewka wody jest zamknięta między dwiema warstwami mydła, których łańcuchy alkilowe są skierowane na zewnątrz.
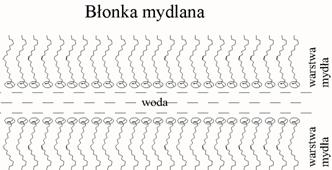
Barwy interferencyjne błon mydlanych (barwy cienkich warstw) są przykładem zjawisk emergentnych (mydło i woda są bezbarwne). Bezbarwne błony mydlane (black foams) powstają wtedy kiedy stają się zbyt cienkie, aby pojawiła się interferencja w zakresie widzialnym.
W obu typach błon grupy polarne (lipidów i detergentów) są skierowane ku środowisku wodnemu a ich łańcuchy niepolarne są skierowane ku innym łańcuchom niepolarnym albo w powietrze. Ta tendencja „swój do swego” stanowi podstawę mechanizmu tworzenia się tzw. liotropowych ciekłych kryształów w roztworach mydeł lub lipidów.