GAZ IDEALNY
Równanie
stanu gazu idealnego
* Równanie stanu gazu idealnego

Termin ‘gaz’ został po
raz pierwszy użyty przez Johanna Baptistę van Helmonta (1577 - 1644) i ma
prawdopodobnie związek ze słowem ‘chaos’.
Na podstawie badań eksperymentalnych stwierdzono istnienie ważnych
relacji między dwoma parametrami stanu gazu. Relacje te to prawo Charle’a
(proporcjonalność objętości do temperatury) i prawo Gay-Lusac’a
(proporcjonalność ciśnienia od temperatury).
Prawo Charle’a:
Objętość
danej ilości gazu przy ustalonym ciśnieniu jest wprost proporcjonalna do
temperatury bezwzględnej
![]()
Prawo
Gay-Lusac’a:
Ciśnienie
w danej ilości gazu przy ustalonej objętości jest wprost proporcjonalna do
temperatury bezwzględnej
![]()
Ścisły opis teoretyczny własności
gazów rzeczywistych nie jest obecnie osiągalny. Dotyczy to zwłaszcza gazów o
dużych cząstkach, które mogą ze sobą oddziaływać w bardzo skomplikowany sposób.
Do takich gazów należy chociażby para wodna, ale i pary węglowodorów (benzyna,
oleje) oraz innych substancji lotnych. Aby umożliwić sobie przybliżony opis
własności gazów stworzono pojecie gazu idealnego
(doskonałego). Gaz idealny ma wszystkie cechy zupełnie niefizyczne:
- składa się z cząstek punktowych
(które nie mają rozmiarów) ale mają masy m, co oznacza, że mają nieskończoną
gęstość;
-
cząstki gazu nie oddziaływają na siebie na odległość ale mogą przekazywać
między sobą energię podczas wzajemnych zderzeń (chociaż zderzenia nie są
możliwe wobec zerowych rozmiarów cząstek).

Równaniem stanu nazywamy każdą funkcję stanu, która łączy wszystkie parametry stanu układu. Niestety, nie znamy ścisłego równania stanu dla żadnej rzeczywistej substancji. Stworzono takie równanie stanu jedynie dla gazu idealnego czyli dla układu nie istniejącego w rzeczywistości. Równanie stanu gazu doskonałego piszemy w postaci
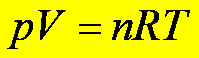
gdzie n jest liczbą moli gazu, zaś R jest nazywane uniwersalną stałą gazową: R = 8.31 J/mol·K = 1.986 cal/mol·K
Biorąc liczbę Avogadro,![]() , możemy zapisać równanie stanu w postaci
, możemy zapisać równanie stanu w postaci
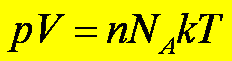
gdzie k jest stałą Boltzmanna, ![]()
|
Ważne, aby
pamiętać, że równanie stanu obowiązuje zawsze, niezależnie od rodzaju procesu
termodynamicznego, w jakim bierze udział gaz idealny. |